主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

3CL蛋白酶因其在冠状病毒复制中的核心作用和高度保守性,被认为是广谱抗冠状病毒药物的理想靶点,现已有多个3CL蛋白酶抑制剂获批上市。但研究表明,目前已获批的药物虽然对β属冠状病毒3CL蛋白酶有效,但在面对其他属类(α、γ、δ)冠状病毒3CL蛋白酶时,其抑制效率明显下降,尤其是针对上述新发现的可感染人的PDCoV和CCoV-HuPn-2018的3CL蛋白酶抑制效率较为微弱。因此,为应对日益复杂的冠状病毒谱系,并储备能抵御未知变异毒株的候选药物,亟需开发能覆盖全谱系“超广谱”3CL蛋白酶抑制剂。
近日,中国科学院上海药物研究所等研究团队,针对冠状病毒传播潜力及其耐药性挑战,突破了现有3CL蛋白酶抑制剂广谱性不足的局限,即通过对全谱系冠状病毒3CL蛋白酶进行深度生物信息学与结构解析研究,设计并获得了具有“超广谱”活性的3CL蛋白酶抑制剂,为研发广谱抗冠状病毒药物提供了通用设计策略。
研究团队对涵盖α、β、γ、δ四种属类、26个亚属的59种冠状病毒3CL蛋白酶进行了系统的序列和结构分析,发现底物结合口袋中的S2和S4亚位点是决定抑制剂广谱活性的关键变异区域。随后,研究人员以奈玛特韦为起点,通过解析其与PDCoV和CCoV-HuPn-2018 3CL蛋白酶的高分辨率晶体结构,并与SARS-CoV-2 3CL蛋白酶复合物结构进行对比分析,揭示了奈玛特韦对两种新病毒3CL蛋白酶活性减弱的分子机制,强调了修饰奈玛特韦P2和P4片段,以增强广谱抑制活性的重要性。
基于此,研究团队利用基于结构的药物设计策略对奈玛特韦结构进行优化。研究发现,通过缩小P2片段体积,并采用非环状结构,可避开不同属病毒3CL蛋白酶S2口袋的空间位阻。同时,通过精细调控P4片段,可增强对α属病毒的适应性。经过多轮优化,研究团队发现了化合物8。该化合物在分子水平和细胞水平,对四种属类代表性的3CL蛋白酶均表现出强效抑制活性,即IC50值均小于100nM,EC50值处于1.2-13.4μM区间。
为全面评估化合物8的广谱活性,研究团队进一步拓展了对该化合物的广谱性评价谱系范围。结果显示,化合物8对32种涵盖所有亚属的3CL蛋白酶均表现出纳摩尔级的强效抑制活性(IC50:19-146nM),并对多种临床常见的奈玛特韦耐药突变体保持高度敏感。同时,细胞水平抗病毒实验结果表明,化合物8对包括HCoV-OC43、HCoV-229E、SARS-CoV-2及其多种变体在内的人类冠状病毒均具有良好抗病毒活性(EC50:0.01-3.3 μM),其体内抗病毒疗效也在HCoV-OC43感染的小鼠模型中得到验证。
该研究系统探索并形成了一套针对广谱抗病毒药物靶点开展“超广谱”抑制剂设计的完整流程和通用策略,为研发下一代广谱抗冠状病毒药物奠定了基础,也为应对未来可能出现的新型病毒提供了前瞻性储备。
相关研究成果发表在《先进科学》(Advanced Science)上。研究工作得到国家自然科学基金委员会、科学技术部、中国科学院、湖北省等的支持。
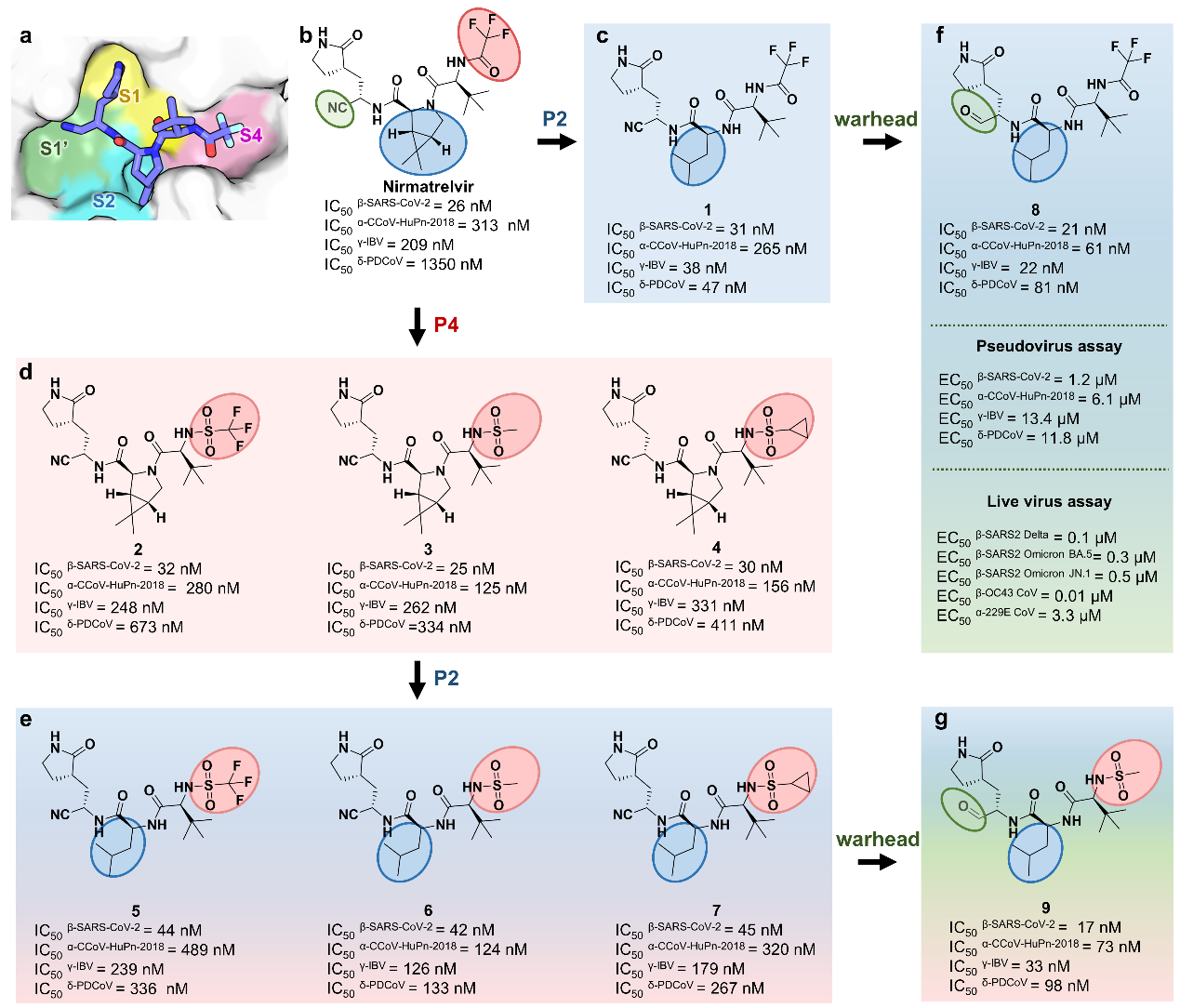
基于结构的广谱3CL蛋白酶抑制剂设计与优化
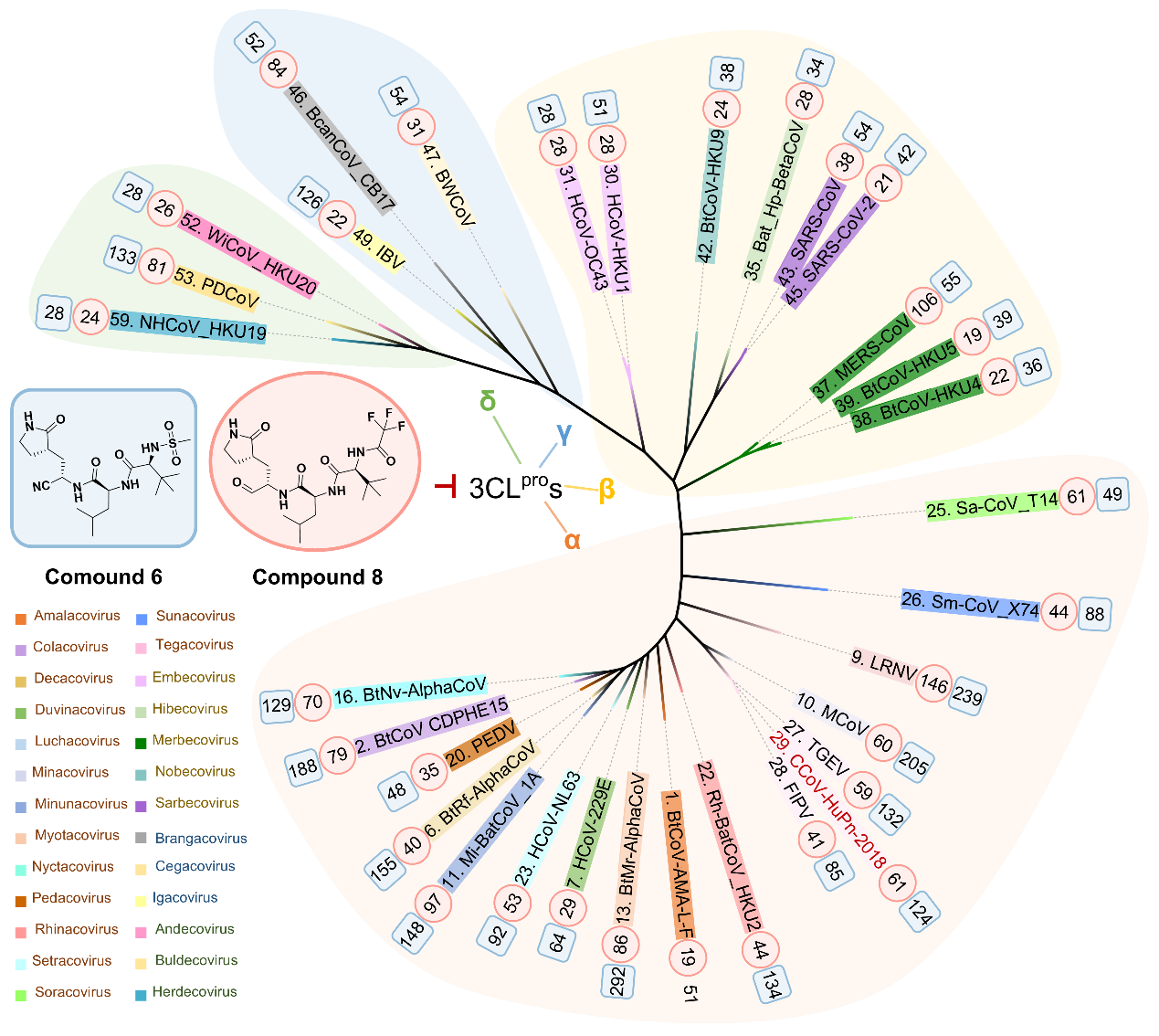
化合物8的“超广谱”抑制活性

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














