主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

单胺类神经递质包括去甲肾上腺素、肾上腺素、多巴胺、血清素和组胺等,在神经系统和其他组织中发挥着重要的生理作用。囊泡单胺转运蛋白(VMAT2)是中枢神经系统中唯一介导单胺类神经递质储存的转运蛋白。VMAT2利用质子的电化学势,以2:1的质子与底物的化学计量比,将神经递质或神经毒素MPP+转运进入囊泡中,在介导神经冲动传递和神经保护方面具有关键作用。
前期,科研人员在VMAT2结构功能研究中提出了见解,但关于VMAT2如何识别并转运不同化学结构的其他单胺类神经递质以及帕金森病诱导剂MPP+的作用机制等问题仍不清楚。此外,质子耦联底物转运的分子机制仍需要进一步研究。
5月22日,中国科学院生物物理研究所赵岩团队联合中国科学院物理研究所/北京凝聚态物理国家研究中心姜道华团队,在《细胞研究》(Cell Research)上在线发表了题为Structural snapshots of human VMAT2 reveal insights into substrate recognition and proton coupling mechanism的研究论文。该研究报道了人源囊泡单胺转运蛋白 (hVMAT2) 在低pH下的apo结构,分别结合去甲肾上腺素、多巴胺、组胺、神经毒素MPP+的囊泡腔朝向的复合物结构,以及结合去甲肾上腺素的胞质朝向的复合物结构 ,揭示了VMAT2识别不同底物的结构基础,并进一步完善了质子耦合底物转运的分子机制。
尽管去甲肾上腺素、多巴胺、血清素和MPP+的分子结构各异,但结合这些底物的VMAT2复合物结构表明它们均结合于转运蛋白的相似位置。然而,这些底物分子的某些官能团的细微差异,导致其与转运蛋白的相互作用和结合模式存在差异。这揭示了VMAT2如何有效地识别不同的底物分子。同时,组胺结合在一个不同于其他底物结合的位置。结合功能实验,研究人员验证了该位点的可靠性。
此外,该研究报道了在不同构象下去甲肾上腺素与VMAT2结合的结构,包括胞质朝向和囊泡腔朝向的构象。在伴随底物转运的构象变化过程中,N端结构域相对于C端结构域发生了约30°的旋转,交替地将底物结合位点暴露于胞质侧或囊泡腔侧,实现了底物在囊泡中的富集。尽管VMAT2经历了较大的构象变化,但去甲肾上腺素的底物结合口袋在这一过程中仍保持相对稳定,与周围残基的相互作用亦没有发生显著变化。这种巧妙的构象转换特点对于VMAT2的功能至关重要。
前期研究报道了D399残基可能是偶联底物结合与质子化的关键位点,并在N端结构域内发现一个氢键网络。这个氢键网络可能在偶联质子结合,促进VMAT2构象转换中发挥关键作用。该研究通过解析VMAT2在不同pH条件下的结构,确认了D33可能是另一个关键质子化位点。具体而言,D33的质子化可以诱导D33、R189和Q192残基侧链的局部构象变化,破坏了氢键网络,从而推动了VMAT2构象从囊泡腔朝向转换为胞质朝向。
该研究剖析了VMAT2识别具有不同化学结构的单胺类神经递质以及神经毒素分子的机制,提出了VMAT2构象变化的分子机制模型,并完善了质子耦联底物转运的具体机理。上述成果为探讨VMAT2的转运模式提供了有益的见解,丰富了科学家对主要协同转运体超家族转运底物分子机理的认识,并为药物开发与优化奠定了基础。
研究工作得到国家自然科学基金和中国科学院战略性先导科技专项(B类)的资助。冷冻电镜数据收集工作得到生物物理所蛋白质科学研究平台生物成像中心、物理所冷冻电镜中心及软物质公共仪器平台、北京大学现代农业研究院生物微观结构研究平台的技术支持。功能实验得到生物物理所和中国科学院微生物研究所放射性同位素实验室的协助。
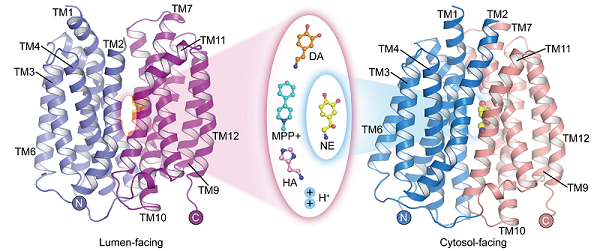
VMAT2结合神经递质和神经毒素的结构

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














