主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

近日,中国科学院生物物理研究所研究员胡俊杰团队在《自然-通讯》(Nature Communications)上在线发表题为Oligomeric scaffolding for curvature generation by ER tubule-forming proteins的研究论文,同时在《细胞科学杂志》(Journal of Cell Science)上在线发表题为Molecular basis of Climp63-mediated ER lumen spacing的研究论文,这两篇论文系统解析了内质网“成管蛋白”"诱导管状曲度与片状边缘曲度的分子机制,以及内质网腔体“桥连蛋白”调控片状内质网厚度的结构基础。
内质网是真核细胞的关键细胞器,负责蛋白合成、脂质合成及钙存储等重要过程。从形态上讲,内质网是一个由管状和片状交织而成的连续的膜系统。管状内质网的发生依赖RTN和REEP家族的整合膜蛋白,这些蛋白通过稳定膜曲度来诱导管状结构截面和片状结构边缘的膜弯曲,而片状的厚度主要由Climp63来决定。内质网的塑形与其生理功能有着直接的关联。然而,这些塑形蛋白易多聚且不均一,对塑形机制的解析造成了严重阻碍。
研究人员运用近期发展的基于深度学习的结构预测方法,推测了酵母成管蛋白Yop1p的构象,发现其分子内的跨膜区等元件都相互锁定在一个较为稳定的位置。他们通过化学交联和3D打印模型拼接等,阐明了Yop1p多个二聚化界面的组合方式,并发现Yop1p的多聚体具有弯曲的特征,其曲度与内质网管状结构吻合。此外,Yop1p的同源蛋白REEP1与遗传性痉挛性截瘫关联,其多个突变与破坏REEP1的聚合直接相关,证明了成管蛋白聚合装配的重要性。
研究人员运用类似的策略预测了Climp63的结构,发现Climp63的腔内结构域主要以螺旋为主,多个预测模型的差异显示了螺旋束的紧密程度较弱。研究发现,其中一种构象若形成末端相对的二聚体,其长度符合细胞内观察到的内质网片状厚度。交联实验验证了这一二聚化界面的存在,但Climp63的腔内结构域表面富含电荷簇,有可能以多种方式形成同侧或对侧的聚合。此外,研究还发现Climp63的同侧聚合也与对侧聚合有相互偶联的调控。
总体来说,这些工作表明生物膜塑形通常依赖塑形蛋白的多聚化调控,而塑形蛋白往往综合多个较弱的同源互作界面来实现最终的塑形多聚体。这种调控模式使得塑形机制的可调控性和可塑性变得很强。同样的理论也适用于细胞器互作中膜接触位点的建立。
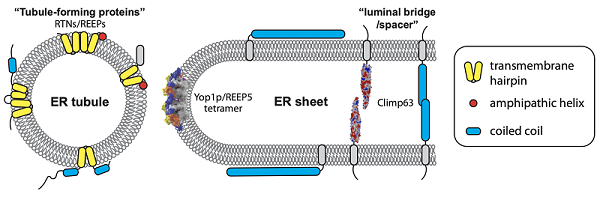
内质网塑形分子与塑形机制示意图

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














