
语音播报

中国科学院上海营养与健康研究所丁秋蓉研究组在《分子细胞》(Molecular Cell)上,在线发表了题为Histone phosphorylation integrates the hepatic glucagon-PKA-CREB gluconeogenesis program in response to fasting的研究论文。该研究发现了组蛋白H3S28磷酸化(H3S28ph)响应饥饿情况下胰高血糖素信号,直接调控肝脏糖异生基因转录激活的生物学机制:在饥饿状态下,胰高血糖素激活PKA信号通路,PKA继而被CREB招募到基因组糖异生基因调控区域,磷酸化H3S28。磷酸化的H3S28ph被14-3-3ζ识别,招募更多的RNA聚合酶II(Pol II),激活糖异生基因转录。同时,研究发现,进食状态下,PP2A作为H3S28ph的磷酸酶抑制其磷酸化,继而抑制糖异生基因的表达。该研究发现了组蛋白磷酸化在肝脏糖稳态调控中的生物学功能,并发现了CREB作为桥梁蛋白介导PKA磷酸化H3S28继而调控糖异生基因转录的调控模式。
高血糖是2型糖尿病(T2D)的临床特征,也是包括脂肪肝、肥胖等多种代谢性疾病的关键风险因素。肝脏组织在维持机体糖代谢稳态中起到重要作用,而肝葡萄糖生成(HGP,hepatic glucose production)的失调会明显加速T2D的发生和发展。肝脏HGP主要包括肝糖原的分解和糖异生。在饥饿状态下,HGP主要来自于糖异生,而在T2D患者中,由于胰岛素抵抗的发生,糖异生速率增加,进一步导致了空腹血糖的增高。靶向肝脏糖异生是治疗T2D的潜在策略之一。
糖异生(Gluconeogenesis)是指非糖前体(丙酮酸、乳酸、甘油、生糖氨基酸等)转变为糖或糖原的过程。在正常生理状态下,饥饿时血糖迅速下降,肝脏内会发生快速的糖异生基因的表达,促进糖异生,以维持正常血糖稳态。糖异生基因包括编码糖异生限速酶磷酸烯醇式丙酮酸羧激酶1的基因PCK1、编码葡萄糖-6-磷酸脱氢酶的基因G6PC等,其转录调控主要通过CREB和Foxo1两个关键转录因子介导的信号轴进行。然而,基因转录的快速启动依赖于转录因子的激活,组蛋白修饰改变导致的大范围内染色质开放或闭合状态的重塑决定基因转录激活的敏感性和有效性。在饥饿状态下糖异生基因转录的快速启动过程中,染色质层面发生了什么相应变化,尚不清晰。
丁秋蓉团队广泛筛选饥饿刺激的肝脏内组蛋白翻译后修饰变化发现,H3S28ph显著上升。研究结合RNA-seq和H3S28ph的ChIP-seq、CUT&Tag结果,发现饥饿会诱导H3S28ph信号的明显增加,尤其是在糖异生相关基因的转录调控区域。进一步,研究通过肝脏特异过表达野生型H3.3(H3.3-wt)和突变型H3.3(模拟磷酸化突变H3.3-S28D和非磷酸化突变H3.3-S28A),证明H3.3-S28D可以显著促进肝脏糖异生基因表达和糖异生。
研究进一步探究了H3S28ph的调控机制,发现胰高血糖素可以体内、体外促进肝细胞H3S28ph的发生,并通过一系列生化实验和体内功能实验证明,细胞核内的PKA是H3S28ph的激酶。研究进一步发现,PKA特异结合到糖异生基因调控区域依赖于CREB的招募,PP2A是H3S28ph的磷酸酶并抑制肝脏糖异生基因的表达。
该团队针对H3S28ph如何激活糖异生表达的机制研究,通过蛋白质谱分析发现在饥饿情况下,肝脏细胞核内的14-3-3ζ表达上升。进一步,体外和CUT&Tag等实验证明,14-3-3ζ是H3S28ph的表观阅读器,14-3-3ζ可识别H3S28ph,并招募更多的Pol II到糖异生基因启动子区域,促进基因转录;而敲除肝脏14-3-3ζ可以明显抑制糖异生。
该研究揭示了组蛋白磷酸化修饰快速响应饥饿刺激的胰高血糖素-PKA信号通路,进而促进肝脏糖异生基因转录的工作机制,丰富了对机体在染色质层面如何响应激素变化,调控代谢稳态的生物学认识。
研究工作得到国家自然科学基金委员会、上海市科学技术委员会、中国科学院青年创新促进会的资助,并获得营养与健康所公共技术中心和动物平台的支持。
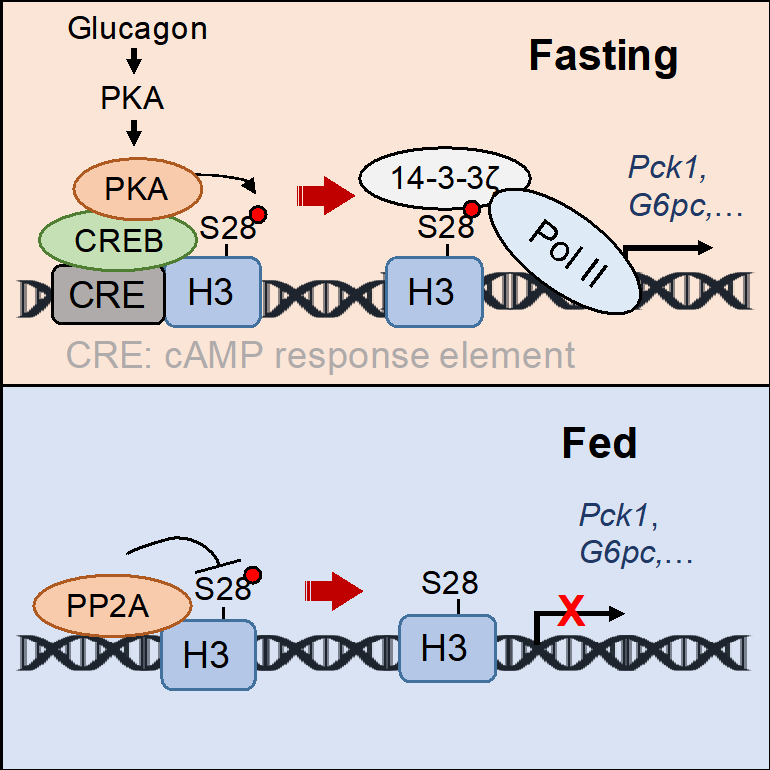
在饥饿情况,血液内胰高血糖素上升并与肝脏上受体结合,促进肝脏细胞内cAMP上升。PKA被激活并释放出催化亚基,与基因组上的CREB结合后促进H3S28ph。14-3-3ζ作为表观阅读器识别H3S28ph并招募RNA聚合酶II激活糖异生基因转录。相反地,PP2A是H3S28ph磷酸酶并抑制糖异生基因表达。

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
