主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

近日,中国科学院武汉病毒研究所/生物安全大科学研究中心曹晟课题组和胡志红课题组合作,在Journal of Virology上,在线发表了题为《口服感染因子PIF5的结构特征揭示杆状病毒口服感染过程中分子内相互作用的重要作用》(Structural Characterization of Per Os Infectivity Factor 5 (PIF5) Reveals the Essential Role of Intramolecular Interactions in Baculoviral Oral Infectivity)的研究论文。
杆状病毒在昆虫中的初始感染由一系列被称作口服感染因子(Per Os Infectivity Factors,PIFs)的蛋白分子参与完成。杆状病毒的代表种AcMNPV具有10个PIFs,除PIF5外,其他PIFs会形成复杂的复合物,缺失PIF5的病毒完全丧失对昆虫的口服感染能力。该研究通过晶体学手段解析得到PIF5胞外域(PIF5 ectodomain,PIF5e)分辨率达2.2埃的晶体结构,这是迄今首个报道的杆状病毒口服感染因子结构。
依据三级结构特征,PIF5e可被分为位于N端的E1与C端的E2结构域,两结构域之间通过氢键与盐桥紧密联系,在作用界面上形成一个开放式的口袋,口袋底部两个残基R8和R74与E2结构域构建了复杂的氢键网络。科研人员构建了一系列可能影响分子结构的突变体,发现R8和R74位点突变的病毒口服感染能力明显下降。进一步的生化实验证实,R8和R74位点突变的PIF5会在碱性环境中被蛋白酶所降解,从而丧失口服感染能力,表明分子内相互作用在PIF5抵抗中肠碱性环境下的蛋白酶解过程中发挥重要作用。
研究工作得到中科院前沿科学重点研究计划的支持。
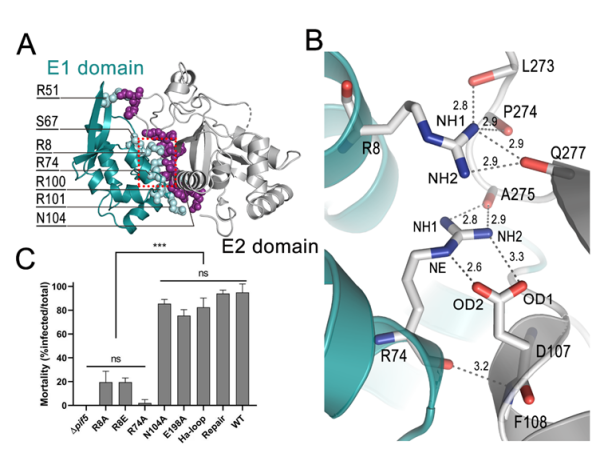
A、PIF5中E1和E2结构域以及两结构域间紧密的相互作用;B、位于口袋底部的R8和R74两个残基参与构筑的氢键网络;C、不同位点的突变对病毒口服感染能力的影响。

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














