主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

哺乳动物Na+/H+逆向转运蛋白(Na+/H+ exchangers, NHEs)属于CPA1蛋白超家族,在生物膜两侧逆向转运质子和钠离子。NHE家族介导了离子的跨膜电中性转运,在调控胞内钠离子和pH稳态中发挥着重要功能。NHE3在人的胆囊中特异性表达,与胆囊中的水和电解质的吸收,以及管腔质子分泌相关。NHE3转运活性的调控由多种信号分子和调控蛋白参与。其中,神经磷酸酶B-同源蛋白1(CHP1)是NHE3蛋白发挥功能所必需的调控亚基,并与NHE3形成复合物。当NHE3活性降低时,胆囊吸收胆汁减少,从而使胆囊浓缩胆汁功能下降,诱发胆囊胆固醇结石等疾病的发生。NHE3功能失调导致的人类疾病还包括胆汁淤积、囊性纤维化、溃疡性结肠炎、腹泻和肠易激综合症等。
5月25日,中国科学院生物物理研究所赵岩课题组、张凯课题组和加拿大麦吉尔大学的John Orlowski课题组在Science Advances上合作发表题为Structural basis of autoinhibition of the human NHE3-CHP1 complex的研究论文。该研究报道了人源NHE3-CHP1内向开口构象的复合物结构,揭示了NHE3自抑制调控机制、磷脂酰肌醇分子(PI)增强NHE3转运活性的分子机理,以及CHP1对NHE3活性的调控机制。
2021年,该团队首次报道了NHE1-CHP1复合物内向构象和结合Cariporide的外向构象的高分辨率结构,系统揭示了NHE1在底物转运过程中的构象变化,并阐明了NHE1识别药物分子的机理。但是关于该家族蛋白的转运机制仍有关键问题尚未得到解决。例如,蛋白的C末端柔性区域以及脂分子如何调控转运蛋白的活性?近期,研究人员利用冷冻电镜单颗粒技术,解析了人源NHE3-CHP1复合物内向开口构象的高分辨率结构。在总体结构上,人源NHE3与NHE1结构类似,均呈现同源二聚体形式,每个单体包含13个跨膜螺旋。研究人员首次解析了NHE3的C末端结构域结构,包括HC4螺旋、HC5螺旋及它们之间的loop,形成一个发卡状模体结构。该模体像一个“塞子”插入了胞内侧负责结合底物的负电性空腔中,堵塞了细胞内侧空腔的入口。通过与NHE1外向开口状态的结构比对,该模体的结合同样抑制了转运蛋白的构象变化。因此,研究人员推测该结构处在抑制状态。功能实验也表明,HLH模体可以将NHE3的活性抑制在较低水平。此外,研究人员还发现了两个磷脂酰肌醇(PI)分子结合在NHE3二体界面外周近膜侧,发挥了锚定和稳定复合物结构的功能,这可能与PI增强NHE3的转运活性相关。
研究工作得到中科院战略性先导科技专项(B类)、国家重点研发计划、国家自然科学基金和加拿大创新基金会(Canadian Foundation for Innovation)的支持。
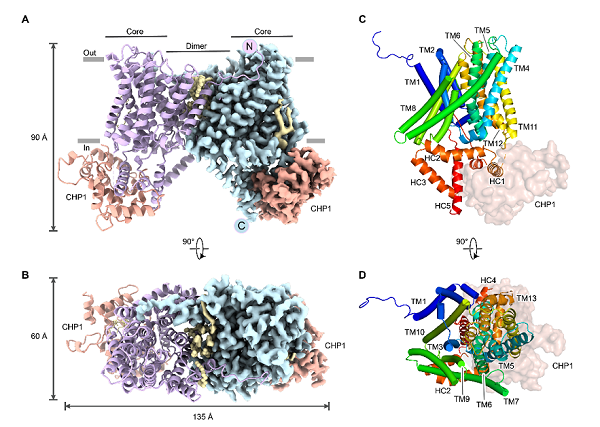
NHE3-CHP1复合物的整体结构
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














