主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

植物逆境激素ABA不仅影响种子萌发、植物生长发育和衰老,而且对植物在干旱和盐碱等各种逆境条件下生存起到关键作用。已知逆境能够迅速诱导植物体内ABA的积累,当ABA受体PYR/PYL/RCAR感知到ABA分子后会与其共受体PP2C互作并抑制PP2C磷酸酶活性,从而解除PP2C对于ABA信号途径中关键正调控因子SnRK2激酶的抑制作用。SnRK2便可以磷酸化并激活一系列ABA信号途径的响应因子,帮助植物抵抗逆境。因此,ABA信号接受研究对于提高植物的耐逆性等具有重要意义。
中国科学院遗传与发育生物学研究所谢旗研究组前期研究发现内膜分选复合体I中的关键组分VPS23A发挥着识别和分选泛素化修饰的ABA受体并促进其进入液泡中降解的重要作用(Yu et al., Molecular Plant,2016)。进一步研究发现,VPS23A受到E3泛素连接酶XBAT35.2的泛素化修饰,并进入26S蛋白酶体降解,从而释放VPS23A对ABA受体的抑制作用,最终促进ABA信号响应(Yu et al., Molecular Plant,2020)。ABA受体、VPS23A和XBAT35.2三者之间的关系是经典的“螳螂捕蝉,黄雀在后”。
4月6日,谢旗研究组在Science Advances上,在线发表了题为The deubiquitinases UBP12 and UBP13 integrate with the E3 ubiquitin ligase XBAT35.2 to modulate VPS23A stability in ABA signaling的研究论文(DOI:10.1126/sciadv.abl5765),揭示了去泛素化酶在ABA信号接受调控中的全新机制。
谢旗研究组运用蛋白互作技术,鉴定到VPS23A的互作蛋白去泛素化酶UBP12和UBP13。UBP12和UBP13突变体表型分析发现,它们参与ABA信号介导的气孔运动,并抑制整株植物的失水速率及蒸腾作用,增强ABA介导的植物耐旱性。进一步遗传学分析证实了UBP12和UBP13通过VPS23A参与调控ABA信号途径及植物对干旱胁迫的响应。因此,E3泛素连接酶XBAT35.2和去泛素化酶UBP12和UBP13发挥着“油门”和“刹车”的作用,精细调控VPS23A泛素化水平,影响ABA受体蛋白水平来响应外界环境变化。
研究进一步发现VPS23A的E3泛素连接酶XBAT35.2也是UBP12和UBP13的去泛素化底物。UBP12和UBP13在ABA处理条件下可以去泛素化并稳定XBAT35.2。精细的蛋白互作竞争实验证实了XBAT35.2与VPS23A竞争结合UBP12和UBP13,以此削弱UBP12和UBP13对VPS23A的保护。研究表明,ABA处理时,去泛素化酶UBP12和UBP13具有“变阻器”的功能,介导E3泛素连接酶XBAT35.2的去泛素化,促进XBAT35.2蛋白积累,形成VPS23A的正反馈调节回路(feed-forward loop),稳定ABA受体蛋白,及时有效激活ABA信号转导,帮助植物增强耐旱性(如图)。
在真核生物中,泛素化与去泛素化在调控底物蛋白稳定性中均具有重要作用。近年来,关于E3泛素连接酶、去泛素化酶及底物蛋白之间调控模式的研究是动物泛素化研究领域的热点,而植物中未有相关报道。该研究首次揭示了植物中也存在E3泛素连接酶和去泛素化酶之间的相互作用关系,并证明了这种机制在动植物中的保守性。研究表明E3泛素连接酶与去泛素化酶之间的互作在生物体内或广泛存在,这种互作调控关系在响应外界干旱环境从而动态调节相关底物蛋白的功能过程中发挥关键作用。
研究工作得到国家重点研发计划和国家自然科学基金的支持。
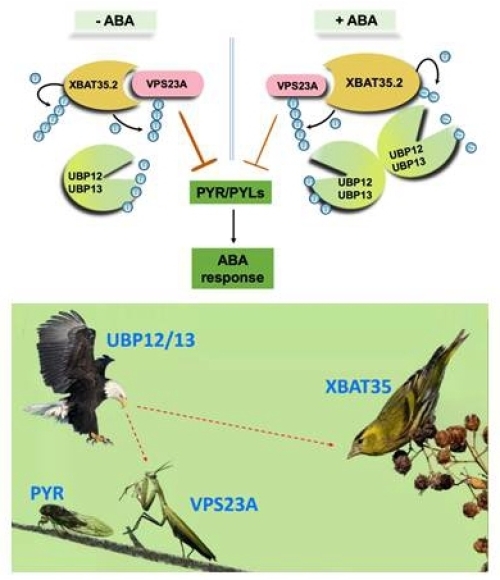
UBP12/UBP13在ABA信号接受中精细调控模型

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














