主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

HBV感染是我国原发性肝癌最主要的致病因素。作为这种慢性感染性肝炎导致的肿瘤,HBV相关肝癌具有与其他类型截然不同的发病机制和治疗特点,例如肝癌晚期一线药物索拉非尼在HBV单阳性肝癌中疗效不显著。此外,HBV感染还与肝癌门静脉癌栓等血管转移密切相关。打破HBV相关肝癌的免疫耐受,寻求靶向T细胞免疫治疗新靶点有重要的科研意义及临床应用价值。
近期,中国科学院生物物理研究所杨鹏远课题组、解放军总医院第五医学中心等合作,在Journal of Hepatology发表研究论文Intratumoral stem-like CCR4+ regulatory T cells orchestrate the immunosuppressive microenvironment in HCC associated with hepatitis B,阐述瘤内CCR4介导调节性T细胞(Treg)促进HBV相关肝癌免疫逃逸新机制,揭示CCR4+ Treg亚群的干细胞样表观遗传调控特征,为HBV相关肝癌的防治提供了新的理论基础和干预策略。
生物物理所多年来持续关注HBV相关肝癌中负向免疫调节功能Treg细胞的聚集机制。前期研究发现,HBV通过活化TGF-β信号促进趋化因子CCL22表达,诱发Treg细胞迁移至肿瘤组织区域,介导免疫逃逸。在索拉非尼治疗的HBV相关肝癌中激活TNFα/RIP1/NF-κB信号通路显著上调CCL22,招募Treg细胞促进索拉非尼耐药;拮抗CCL22信号通路可打破索拉非尼耐药,有助于解决HBV相关肝癌治疗中一线药物耐药的难题。HBV感染通过HBx促进ERK信号下游趋化因子CXCL8(IL-8)表达,通过其受体CXCR1在肝血窦内皮中特异激活肝内TGF-β信号,促进肝内Treg浸润和血管转移。
近期研究在HBV相关肝癌临床标本及小鼠原位肝癌荷瘤模型等检测到癌组织特异性浸润的Treg细胞高表达趋化因子CCL22受体CCR4,并与HBV滴度及预后显著相关。利用可接近染色质测序(ATAC-seq)及多数据库平台分析发现,这群肿瘤浸润的CCR4+ Treg细胞在TCF7和PD-1染色质区域更加开放,显著上调TCF7转录因子活性,表现出干细胞样表观遗传调控特征。功能研究发现,相较CCR4- Treg,CCR4+ Treg免疫抑制功能更强,通过分泌高水平IL-10、IL-35等抑制杀伤性T细胞功能,促进肿瘤免疫逃逸。利用拮抗剂及自主研发合成的N端融合蛋白靶向CCR4治疗可以显著抑制肿瘤生长,与索拉非尼、PD-1抑制剂等联用可打破药物耐药性,增强免疫治疗效果。值得关注的是,这种靶向CCR4+ Treg能显著抑制瘤内的免疫耐受,但不影响机体正常免疫组织中Treg细胞稳态的维持,避免免疫过度活化等副作用的发生。因此,CCR4可作为一种特异靶向HBV相关肝癌免疫逃逸和肝癌血管转移的药物治疗靶点。
研究得到国家自然科学基金委、中科院和重庆国际免疫研究院的支持。
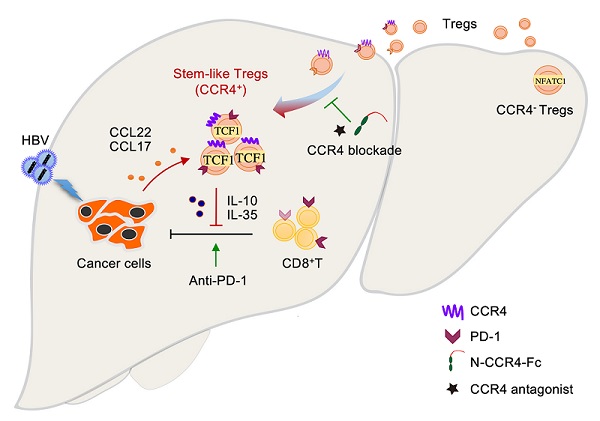
CCR4介导Treg促进HBV相关肝癌免疫逃逸新机制模式图
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














