
语音播报

7月30日,《科学》(Science)以Research Article形式发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员陈玲玲研究组和研究员刘珈泉研究组的合作研究成果——lncRNA SLERT controls phase separation of FC/DFCs to facilitate Pol I transcription,并获同期Perspectives专评。该研究首次揭示了长非编码RNA SLERT以RNA分子伴侣机制改变互作核仁蛋白DDX21构象进而影响FC/DFC区域的大小和流动性,维持RNA聚合酶I高效转录生成核糖体RNA。
核仁是细胞核内的核糖体RNA加工厂,从形态上由内而外可以分为三层结构:纤维中心区(FC)、高密度纤维区(DFC)和颗粒区(GC)。陈玲玲组前期利用超高分辨率显微镜系统,剖析了人类活细胞的核仁三维精细结构,发现核仁含有多个球壳状FC/DFC单元;每个FC/DFC包括2~3个拷贝活跃的rDNA,RNA聚合酶I转录复合物聚集在FC区域边缘对rDNA进行转录;DFC内rRNA前体加工蛋白,如Fibrillarin(FBL)在DFC区域呈现簇状结构,并参与调控rRNA前体的定向转运和核仁DFC的组装(Yao et al.,Mol Cell,2019)。2017年,陈玲玲组发现一条两端以snoRNA结尾的新型长非编码RNA——SLERT定位在细胞核仁,SLERT直接结合核仁蛋白DDX21并调控其形成的环状结构的大小进而促进RNA聚合酶I转录(Xing et al.,Cell,2017)。RNA聚合酶I转录发生在FC和DFC的交界处,SLERT主要定位在DFC区域,那么SLERT是如何通过结合DDX21在精密组装的核仁内对RNA聚合酶I转录活性进行调控呢?
该研究中,研究人员发现SLERT的缺失不仅会导致DDX21簇状球壳结构变小和蛋白流动性降低,还会引起整个FC/DFC转录单元的缩小和固化。基于核仁结构特点,研究人员利用超高分辨率结构照明显微镜(SIM)成像技术,发现DDX21依赖于DFC区域的形成定位在DFC区域外侧,且DDX21层对内层结构具有限制作用,对核仁组装和结构维持的机制有了更深入的认识。
核仁作为细胞内最大的无膜细胞器,其相分离的特征对核仁结构、动态变化及生理功能产生了重要作用。为了进一步研究SLERT调控核仁FC/DFC的机制,研究人员利用体外蛋白质相分离、荧光漂白恢复、沉淀分离等技术手段,发现DDX21蛋白在体外呈现纤维状(fiber)形态,这种DDX21的纤维结构与经典的FBL液滴相比是极度固化的,SLERT能够减弱DDX21的fiber形成程度、提高DDX21蛋白流动性和解除DDX21对FBL的限制作用。
DDX21存在强度相当且相互影响的分子内和分子间相互作用,较强的分子间相互作用导致蛋白多聚化增加,DDX21分子的高度聚集压缩FC/DFC区域的大小,限制FC/DFC区域的流动性;SLERT与DDX21结合增加DDX21分子内相互作用,使DDX21分子呈现闭合构象;闭合构象的DDX21具有较低的分子间结合作用,减弱DDX21对FC/DFC大小的抑制,并且形成较疏松的空间环境以维持RNA聚合酶I的高效转录。
为了进一步研究SLERT调控的DDX21簇如何影响rDNA的转录,陈玲玲组和刘珈泉组合作使用单分子全内反射荧光显微镜(smTIRF),发现DDX21在50nM时会形成数百个分子的蛋白聚集,DDX21分子簇可以结合并卷曲线性的rDNA分子,被DDX21缠绕的rDNA不能与RNA聚合酶I的重要亚基RPA49结合。SLERT促进DDX21闭合的构象和增大DDX21流动性能够阻止DDX21对rDNA的包裹,从而保证RNA聚合酶I复合物在rDNA上的有效占位并进行转录。
lncRNA一般表达量较低,其发挥调控作用的模式一直是该领域探讨的重要问题。然而,传统生物学的“一对一靶向”理论并不完全适用于lncRNA的低剂量分子数和其所控制的生物表型。该研究发现,SLERT可作为RNA分子伴侣低剂量调控DDX21的多聚状态,SLERT倾向于结合开放构象的DDX21,诱导其成闭合状态之后,SLERT会释放闭合构象的DDX21转而结合新的具有开放构象的DDX21,开启下一个功能循环。
该研究首次发现SLERT以RNA分子伴侣机制调控蛋白质的构象和多聚状态,并观察到单分子水平下蛋白质微观相分离的功能特征和调控机制。蛋白质的多聚状态与其流动性、分子间相互作用和功能发挥直接相关,RNA分子伴侣通过跨越数量级调控核仁蛋白质相分离特性维持细胞核仁正常的形态功能,对lncRNA领域和相分离领域的深入研究产生重要影响。研究工作获得国家自然科学基金委、中科院、科学技术部和上海市科委的支持。
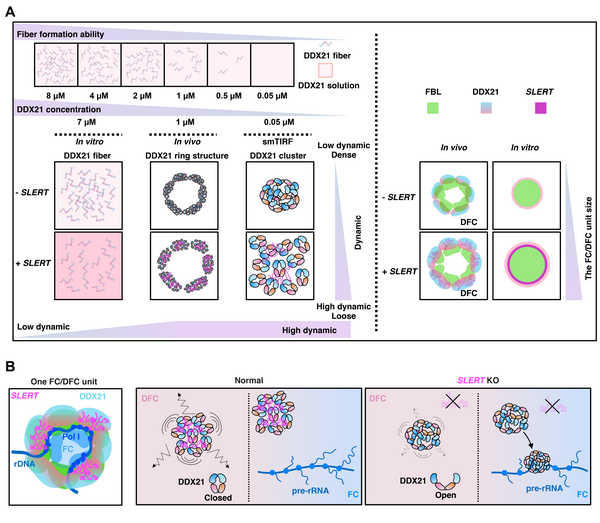
(A)左上:体外相分离实验中,纤维状DDX21的形成随蛋白浓度降低而减弱;左下:在不同的实验体系中,不同浓度的DDX21蛋白呈现出不同的分子状态,SLERT可以增加DDX21蛋白的流动性;右:在体内实验和体外重构实验中,SLERT通过结合DDX21增加FC/DFC转录单元的大小和流动性。(B)DDX21分子抱团聚集在核仁DFC区域的外侧,并且限制FC/DFC区域的大小和流动性。SLERT调控DDX21的构象由开放转为闭合,DDX21分子呈现低聚的疏松状态,为Pol I的高效转录提供合适的空间环境。Pol I转录发生在FC和DFC的交界处,DDX21卷曲缠绕rDNA阻止Pol I转录复合物在rDNA的占位。SLERT调控DDX21的构象和流动性抑制DDX21对rDNA的缠绕从而促进Pol I转录。


© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
