人巨细胞病毒(human cytomegalovirus, HCMV)属于疱疹病毒科β亚家族,是一种在人类中广泛传播的双链DNA包膜病毒。HCMV感染会给免疫能力低下的人群(如器官移植患者或艾滋病人)带来致命危害,此外,还会引发胎儿死亡和新生儿出身缺陷等后果。HCMV具有典型的疱疹病毒三层架构:最外层是含有糖蛋白的脂质双分子层包膜(envelope),最内层是包含dsDNA基因组的准二十面体核衣壳(nucleocapsid),外层包膜和内层核衣壳之间是由蛋白质组成的间层(tegument)。负责基因组包装和转运的核衣壳已成为疱疹病毒新型药物开发的重要靶标。疱疹病毒基因组的包装过程受到核衣壳内部基因组压力的调控,通过一种被称为“head-full”的机制来完成单位长度的基因组包装。然而,Portal不仅作为病毒基因组进出的通道,也被认为是其内部压力的感受器(pressure sensor)。HCMV 的基因组(235 kb)是已知人类病毒中最大的,而其核衣壳粒径大小与其他疱疹病毒的衣壳大小相似,虽然已有多个α-(herpes simplex virus, HSV)和γ-亚家族(Kaposi’s sarcoma-associated virus, KSHV和Epstein-Bar virus, EBV)疱疹病毒的portal原位结构获得解析,但疱疹病毒portal如何感知这些不同的“head-full”信号以及核衣壳如何通过压力变化精准调控基因组转运过程等科学问题尚未被阐明。
7月28日,Nature Communications在线发表了中国科学院上海药物研究所研究员余学奎团队完成的题为Structural Basis for Genome Packaging, Retention, and Ejection in Human Cytomegalovirus的研究长文。该研究利用冷冻电镜技术,解析了首个β亚家族疱疹病毒——HCMV的高分辨率portal与衣壳顶点结合组分(capsid vertex-specific components, CVSC)的原位结构,为理解疱疹病毒基因组包装、稳定和释放过程中“压力感应与调控”的分子机制提供了新思路。
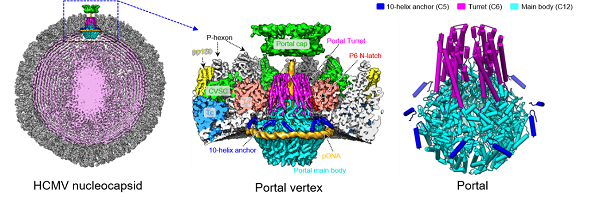
该研究中,研究人员通过优化HCMV病毒培养方案,制备出包膜完整的高质量HCMV样品,并利用冷冻电镜技术解析出HCMV核衣壳portal和CVSC高分辨率原位结构。区别于已报道的其他疱疹病毒portal具有的5次(C5)-12次(C12)的双重对称失配结构特征,HCMV核衣壳portal原位结构呈现出C5-C6-C12的三重对称失配,分别是:C5 10-helix anchor结构域、C6 portal turret结构域和C12 main body结构域。其中,10-helix anchor首次在疱疹病毒中发现,其与紧密环绕portal的一段DNA(pDNA)发生互作。而pDNA在不同疱疹病毒中结构保守,研究人员认为其功能是在基因组包装过程中压缩portal,同时portal也在内部压力的推动下向外移动。当portal达到最外位置且最紧密构象时,便触发“head-full”信号。研究人员进一步提出HCMV特有的10-helix anchor通过作用于pDNA发挥“阻尼器”功能延缓核衣壳达到“head-full”状态,从而实现超大基因组的包装;其次,具有6次对称的portal turret通过其中一组helix结构与相邻一个主要衣壳蛋白的N端helix结构(N-latch)发生互作,为稳定核衣壳内部超大基因组提供了重要支持。此外,研究人员发现病毒包膜破裂后,核衣壳在portal顶点会发生整体位移和局部构象变化,提示病毒通过包膜融合侵入细胞过程中,portal在感应内外压力变化后能够做出及时反馈以保证其内部基因组的稳定和正确释放。
研究人员在前期研究中发现作用于衣壳顶点的CVSC在不同疱疹病毒中的结合数量不同,且与病毒基因组大小呈反相关关系,因此,提出了一种由CVSC辅助的“压力调控”新机制来实现病毒基因组的转运。该研究进一步为该论点提供了支持。研究人员发现HCMV的CVSC结合量显著低于HSV-1、KSHV和EBV,而与之形成对比的是,HCMV包装的基因组是最大的。
综上,该研究描绘了HCMV核衣壳portal的结构保守性与适应性分子特征,进一步探讨了CVSC在病毒基因组转运中的新功能,同时结合病毒包膜融合前后核衣壳所发生的构象变化,系统阐述了疱疹病毒实现病毒基因组包装、稳定和释放等几个关键步骤精准调控的分子机制。研究工作获得国家自然科学基金、上海市自然科学基金与上海扬帆计划资助。
左:HCMV核衣壳冷冻电镜结构;中:HCMV portal顶点冷冻电镜结构;右:HCMV portal原位结构模型



 京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002