主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

脂滴是细胞内脂质贮存的主要场所,在细胞代谢和应激响应中发挥重要作用。真核细胞中的脂滴新生与内质网密切相关。中性脂在内质网膜内合成,并在磷脂双分子层中间聚集形成“透镜”样结构,随着中性脂的不断积累,新生脂滴以“出芽”形式与内质网膜分离,继而成为成熟脂滴。近年来的研究表明,脂滴新生可能与内质网的管状结构有关,且膜曲度在脂滴新生中发挥关键作用,但学界仍不清楚其具体机制。
4月16日,中国科学院生物物理研究所研究员胡俊杰课题组在Journal of Cell Biology上,发表题为FIT2 organizes lipid droplet biogenesis with ER tubule-forming proteins and septins的研究论文,并获得本期杂志的封面报道。该研究揭示了内质网膜蛋白FIT2通过募集内质网成管蛋白REEP5、Rtn4及分隔丝蛋白,协助脂滴从内质网上的形成的分子机制。
研究人员首先利用线虫筛选内质网形态的调控因子,发现内质网整合膜蛋白FIT2(脂肪诱导的跨膜蛋白2)的突变或敲低均会引起片状内质网的扩张,在细胞中过表达FIT2则形成异常的囊泡样结构,内质网膜曲度稳定蛋白(或称成管蛋白)REEP5、Rtn4以及细胞分隔丝蛋白SEPT2均定位于该囊泡结构上。随后,研究人员通过多种生化实验证实了FIT2与REEP5、Rtn4及分隔丝蛋白SEPT7有特异性相互作用。REEP5、Rtn4及分隔丝蛋白的缺失会引起细胞内脂滴变小、数量减少,且内质网脂滴的新生也变少、变慢,说明成管蛋白和分隔丝蛋白参与了脂滴新生的过程。借助多模态结构光超高分辨率显微成像,研究人员观察到活细胞内脂滴新生的过程,发现FIT2、REEP5、Rtn4会在脂滴新生的位置出现短暂聚集,而SEPT7也会动态定位到新生的脂滴上,敲低FIT2会影响新生脂滴与SEPT2的共定位。综上,研究人员提出了内质网成管蛋白和分隔丝蛋白协同FIT2调控脂滴新生的工作模型(如下图),FIT2募集成管蛋白在脂滴新生部位聚集,引发膜曲度,分隔丝蛋白则作为“支架”和“扶手”,稳定新生脂滴的定向出芽。
胡俊杰及其课题组博士颜冰为论文的共同通讯作者,博士陈芳和颜冰为论文的并列第一作者。研究工作得到研究员张宏和李栋的支持,获得国家自然科学基金委、科学技术部、中科院的资助。
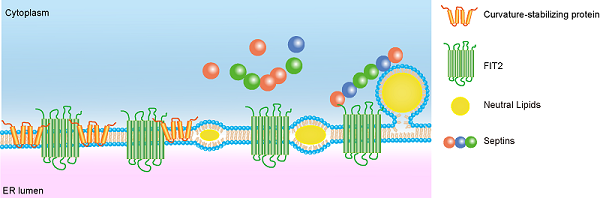
FIT2组织脂滴新生的模型
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














