中国科学院生物物理研究所陈畅研究组继发现II型α亚型磷脂酰肌醇-4-激酶在肿瘤生长中的作用(Oncogenes,2010)之后,与生物物理所孙飞研究组及伊利诺伊大学厄巴纳-香槟分校Klaus Schulten研究组合作,共同于3月28日在Nature Communications报道了关于人源II型α亚型磷脂酰肌醇-4-激酶(hPI4KIIα)的结构功能研究成果Molecular insights into the membrane-associated phosphatidylinositol 4-kinase IIα,该研究成果从分子水平阐明了PI4KIIα激酶活性调节的分子机制。
PI4KIIα是磷脂酰肌醇信号通路和磷脂酰肌醇代谢中的关键分子,在PI(4,5)P2生物合成、溶酶体和高尔基体相关膜转运、细胞内信号通路传导、病原体吞噬和神经突触囊泡循环等方面起着重要作用。PI4KIIα的功能异常与肿瘤生长、痉挛性截瘫、高雪氏症和阿尔茨海默症等人类疾病密切相关,使得PI4KIIα成为了重要的潜在药物靶点。生理条件下,绝大部分PI4KIIα会被棕榈酰化修饰并定位在细胞内膜上(主要为高尔基体膜和溶酶体膜),其激酶活性与棕榈酰化修饰密切相关。此外,胆固醇、β淀粉样肽等生物分子通过改变生物膜的动态流动性也可以调节其活性。然而,其分子调节机制由于没有PI4KIIα的精细结构一直没有得到阐明。
该研究团队解析获得了hPI4KIIα催化核心的ADP结合状态的高分辨率晶体结构,揭示了PI4KIIα不同于PI3K家族蛋白的ATP结合口袋,为针对该潜在靶点的药物设计提供了结构基础;与其它磷脂激酶催化核心相比,研究团队发现PI4KIIα具有三个独特的插入片段——棕榈酰化插入片段(Palmitoylation insertion)、富含RK插入片段(RK-rich insertion)和插入片段3,PI4KIIα通过棕榈酰化插入片段和富含RK插入片段与细胞膜的疏水和静电相互作用紧密结合在细胞膜表面;同时,基于分子动力学模拟和生化分析手段,推测并验证了底物磷脂酰肌醇(PI)的结合口袋;更为重要的是,研究团队通过分子动力学模拟和进一步的生化实验研究证明:膜环境的改变、棕榈酰化修饰可以通过棕榈酰化插入片段的构象涨落来改变底物结合位点的稳定性,从而调节PI4KIIα的激酶活性。
该工作展示了首个PI4K家族成员精细结构,揭示了一种新的磷脂激酶活性调节机理,为下一步发现该激酶的特异性抑制剂及靶向药物奠定了基础,具有重要的生物学意义和应用开发价值。孙飞研究组的硕博研究生周强军博士(现为Stanford University博士后)和陈畅研究组的李江美博士为该文章的共同第一作者。与此同时,陈畅研究组建立了以PI4KIIα与EGFR双靶点联合抗肿瘤新策略(Protein and Cell, 2014)。上述研究得到了科技部“973”计划、“863”计划和国家自然科学基金的资助。
文章链接:1 2
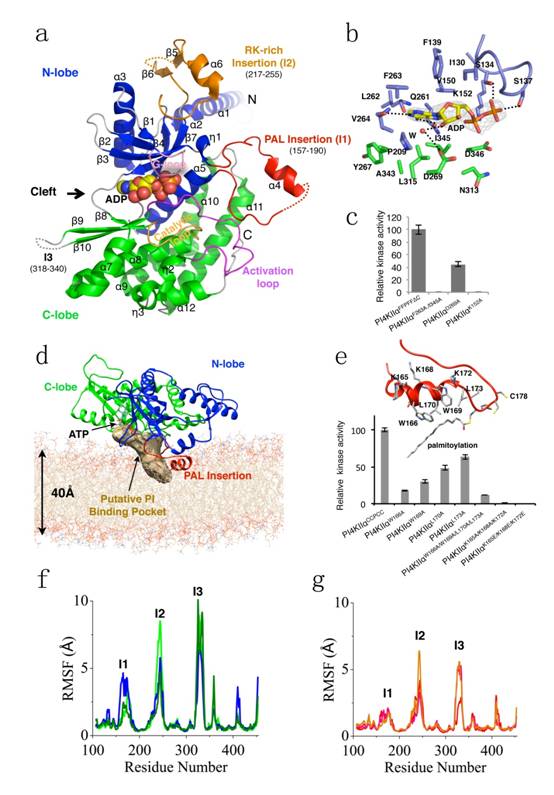
图a,hPI4KIIα催化核心ADP结合状态整体结构;图b,ATP结合口袋ADP与hPI4KIIα的相互作用;图c,ATP结合口袋重要氨基酸残基突变体激酶活性;图d,基于分子动力学模拟推测的PI结合口袋;图e,棕榈酰化插入片段突变体激酶活性测定;图f和g,hPI4KIIα没有被棕榈酰化修饰(f)和被修饰(g)情况下的氨基酸残基构象变化。

 联系我们
联系我们