|
|
|||||||
| 生物物理所揭示核小体抑制cGAS激活的调控机制 |
| 文章来源: | 生物物理研究所 | 发布时间: | 2020-10-16 |
|
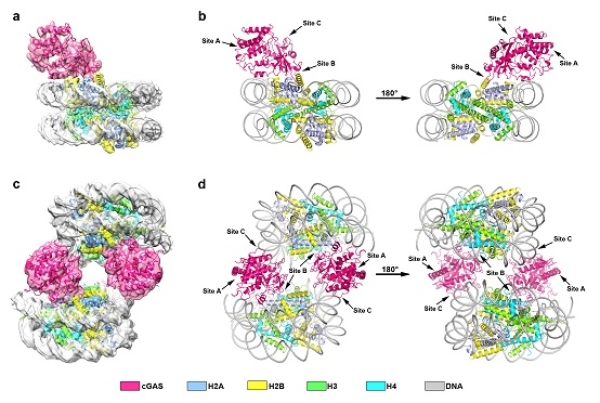
10月13日,中国科学院生物物理研究所章新政研究组与许瑞明研究组合作,在Cell Research上在线发表题为Structural basis for nucleosome-mediated inhibition of cGAS activity的研究论文,解析人源cGAS(cyclic GMP-AMP synthase)与核小体复合物的冷冻电镜结构,揭示核小体竞争性抑制cGAS酶活性的结构基础和作用机制,阐释在细胞核内或特定细胞周期中,cGAS不会通过结合自身dsDNA引起自身免疫系统攻击的原因。 cGAS-STING信号通路是天然免疫系统的组成部分,在对抗外源病原体入侵、细胞损伤等过程中发挥重要作用。cGAS通过识别和结合胞质中的外源dsDNA或细胞损伤产生的自身dsDNA,将底物GTP和ATP催化合成信使小分子cGAMP(cyclic GMP-AMP),cGAMP小分子能够结合并活化STING蛋白,从而激活下游免疫信号通路,介导I型干扰素的产生,引发免疫应答。然而,cGAS对DNA的识别没有序列特异性,因此,cGAS如何避免被自身正常dsDNA激活是相关领域的研究热点之一。有研究认为,cGAS仅存在于胞质中,在特定细胞周期如有丝分裂中核膜破裂将有较多自身DNA被释放出来;也有研究认为,细胞核中有cGAS存在,且富集在染色质区域。在上述两种情况中,cGAS的酶活性均处于抑制状态。近期有研究表明,核小体可与cGAS结合并抑制dsDNA介导的cGAS激活,而具体的作用机制尚不清楚。 基于此,研究团队开展合作,验证核小体可竞争性与cGAS结合并抑制其酶活性,获得两种人源cGAS与核小体复合物的冷冻电镜结构,分别以1:1和2:2形式结合(如图)。cGAS拥有三个dsDNA结合位点(site A/B/C),且三个结合位点均对dsDNA介导的cGAS激活有重要作用。在人源cGAS-核小体复合物结构中,研究发现cGAS以单体形式与核小体结合,其结合位点site B与核小体H2A-H2B的酸性界面之间存在相互作用,结合位点site C中的碱性氨基酸残基则可与相邻核小体的DNA结合。由于空间位阻效应,cGAS的结合位点site A虽然没有直接参与和核小体之间的结合,但是这一区域亦不能被DNA靠近结合。因此,核小体与cGAS之间的相互作用阻挡cGAS与DNA间的识别与结合,破坏cGAS二聚化,从而将其“绑架”在非激活的单体状态。此外,该研究发现cGAS能够与核小体结合形成更高级形式的寡聚体复合物,并获得以4:3比例结合的cGAS-核小体复合物电子密度图。该研究通过一系列体外结合实验和酶活性实验,验证核小体抑制cGAS激活的关键氨基酸残基,以及介导高级形式复合物形成的相互作用区域。 生物物理所研究员章新政和许瑞明为论文共同通讯作者,章新政研究组副研究员曹端方、许瑞明研究组博士后韩晓楠和章新政研究组博士研究生范晓益为论文共同第一作者。研究工作得到国家重点研发计划、国家自然科学基金、中科院战略性先导科技专项和中科院青年创新促进会的支持。
人源cGAS与核小体复合物的冷冻电镜结构示意图 |
| © 1996 - 中国科学院 版权所有 备案序号:京ICP备05002857号 联系我们 地址:北京市三里河路52号 邮编:100864 |