|
|
|||||||
| 微生物所肠道解木糖拟杆菌抗脂肪肝机制研究获进展 |
| 文章来源: | 微生物研究所 | 发布时间: | 2020-08-13 |
|
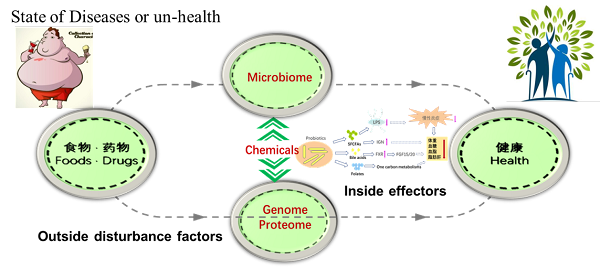
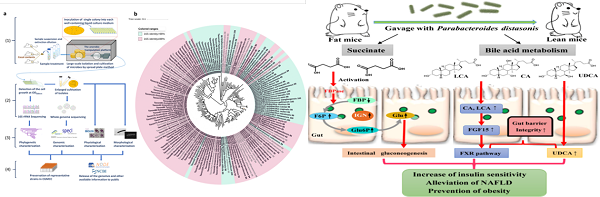
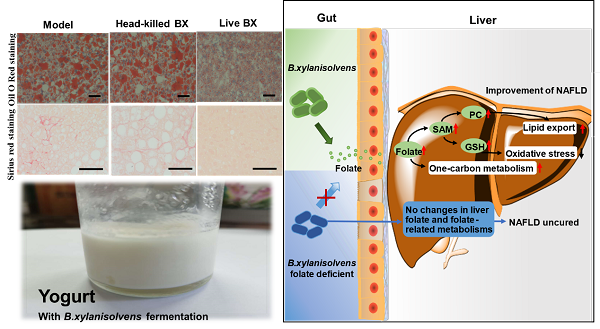
肠道微生物组是人体“第二基因组”,其编码的基因及产物在人体生长、发育,免疫、代谢稳态维持过程中发挥重要作用。肠道微生物数量巨大,物种多样性丰富,包括有益菌和有害菌。如何快速准确的找到肠道菌群中参与人体调节的关键“先生”并阐明其作用机制,是肠道微生物组研究的前沿科学问题。中国科学院微生物所研究员刘宏伟、刘双江团队提出挖掘关键、核心肠道微生物的新策略,采用益生元、难吸收药物等外源分子(Outside disturbance factors)干预机体,扰动肠道菌群结构和组成,寻找丰度显著变化OTU,将其定义为内在效应菌(Inside effectors),进一步阐明效应菌功能和机制(图1)。 前期研究中发现灵芝来源的小分子通过靶向调节肠道菌群的组成、结构,重建健康肠道菌群,发挥减肥、降糖、降脂作用(J. Med. Chem.,2018)。通过培养组比较给药前后小鼠肠道微生物组变化,获得一株给药后显著增加的肠道狄氏副拟杆菌(Nat. Commun.2020)。口服狄氏副拟杆菌显示良好的减肥、降糖、降脂作用。作用机制研究表明:该菌将初级胆酸转化为熊去氧胆酸、石胆酸等次级胆酸,激活次级胆酸介导的肠肝轴途径,发挥降脂作用;通过合成琥珀酸促进肠道糖新生途径,激活肠脑轴通路,发挥减肥和降糖作用(Cell Rep.2019,图2)。 团队利用fa/fa大鼠作为脂肪肝动物模型,研究了口服难吸收灵芝杂萜抗非酒精性脂肪肝作用。灵芝杂萜抑制肝脏脂肪从头合成、促进脂肪酸氧化和低密度脂蛋白运输,抗脂肪肝作用明显。16S测序表明化合物显著富集了具有产叶酸能力的拟杆菌(Bacteroides.spp)和产丁酸的Kineothrix alysoides;KEGG分析显示叶酸(维生素B9)合成及其调控的一碳代谢通路显著增强。通过对B.thetaiotaomicron, B.acidifaciens, B.dorei,and B.uniformi基因组分析发现这四种显著富集的拟杆菌含有完整的叶酸合成途径,但缺失叶酸合成前体pABA的aroD基因。体外添加pABA证实它们可以高效合成叶酸。肠道菌群来源叶酸已经被证实是低碳饮食改善脂肪肝的重要机制(Cell Metab.,2018, 559),但参与叶酸-肝脏通路调节的肠道微生物还缺乏研究。选取化合物干预后增加最显著的解木糖拟杆菌(B.xylanisolvens)深入研究,口服解木糖拟杆菌BX显著增加肝脏、血液中叶酸含量,提高叶酸调控的一碳代谢,显示良好的降脂、降糖、抗脂肪肝作用。敲除叶酸生物合成途径folP基因,获得叶酸合成缺陷株BXΔfolP。体内小鼠实验显示BXΔfolP无抗脂肪肝作用(图3)。该研究证明了肠道拟杆菌-叶酸-肝脏途径在治疗脂肪肝等代谢疾病方面的巨大潜力。研究团队利用人体肠道来源的解木糖拟杆菌研制了酸奶产品(图3)。 以上研究成果以Activation of a specific gut Bacteroides-folate-liver axis benefits for the alleviation of nonalcoholic fatty liver disease为题,在线发表在Cell Reports上。微生物所副研究员乔姗姗、宝丽,博士汪锴为该论文共同第一作者,刘宏伟、刘双江为论文共同通讯作者。
图1.挖掘关键、核心肠道微生物的新策略
图2.小鼠肠道微生物库及狄氏副拟杆菌降脂、降糖机制
图3.解木糖拟杆菌降低脂肪肝作用与叶酸依赖的作用机制 |
| © 1996 - 中国科学院 版权所有 备案序号:京ICP备05002857号 联系我们 地址:北京市三里河路52号 邮编:100864 |