|
|
|||||||
| 微生物所揭示猪链球菌纤连蛋白结合蛋白的结构及功能 |
| 文章来源: | 微生物研究所 | 发布时间: | 2016-11-11 |
|
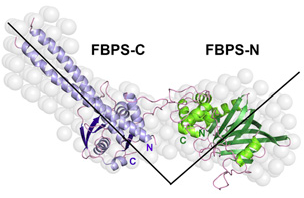
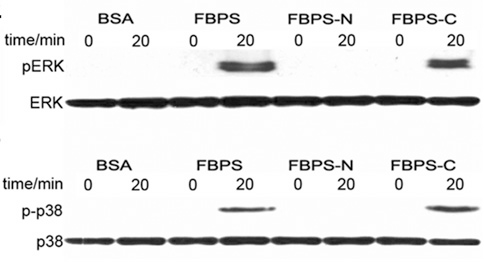
中国科学院微生物研究所高福团队最新研究揭示了猪链球菌纤连蛋白结合蛋白(fibronectin/fibrinogen-binding protein from Streptococcus suis,FBPS)的结构及功能。该项工作发表在11月7日的《美国国家科学院院刊》(PNAS)上。Abednego Moki Musyoki(肯尼亚籍留学生)、史忠玉和宣春玲为该文章的共同第一作者。 猪链球菌(Streptococcus suis)是一类重要的人畜共患病病原菌。该研究团队之前的研究发现猪链球菌感染可引起中毒性休克综合征(PLoS Medicine,2006),对人类健康威胁极大。目前没有疫苗能够有效预防人类感染这种细菌。纤连蛋白结合蛋白(fibronectin-binding proteins, FnBPs)是一类在细菌表面广泛存在的保守组分,在许多革兰氏阳性细菌中能够识别粘附宿主细胞的基质分子,诱导炎症因子的产生。目前已知两类FnBPs,一类可共价锚定于细菌表面,另一类没有前导序列和锚定序列,属于无锚定粘附素。无锚定FnBPs是重要的毒力因子,然而对这类蛋白与宿主纤连蛋白相互作用的分子机制及功能还没有阐明。 高福研究团队成功解析了猪链球菌FBPS蛋白N端及C端的晶体结构,并利用小角散射方法把两部分结构整合得到全长蛋白的结构(图1)。FBPS的N端和C端分别包含两个结构域,整体结构呈顺式构象,如同人的手臂一般。进一步研究发现FBPS C-末端结合宿主纤连蛋白,N-末端附着于细菌表面,从而促进猪链球菌结合宿主细胞,发挥着细菌毒力因子的作用;同时还发现FBPS与纤连蛋白相互作用能够活化β1整合素受体信号通路(图2),诱导炎症因子IL-6和IL-8的产生。这一工作填补了国内外对无锚定FnBPs研究的空白,为今后设计靶向FBPS的药物奠定了结构基础及理论依据。
图1:全长FBPS蛋白的整体结构
图2:FBPS活化宿主的促炎症反应 |
| © 1996 - 中国科学院 版权所有 备案序号:京ICP备05002857号 联系我们 地址:北京市三里河路52号 邮编:100864 |