|
|
|||||||
| 生态中心等在体细胞重编程分子机制研究中取得突破 |
| 文章来源: | 生态环境研究中心 | 发布时间: | 2017-08-07 |
|
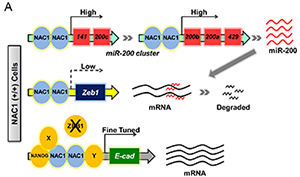
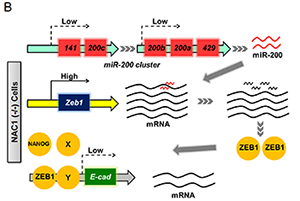
近日,中国科学院生态环境研究中心与美国西奈山伊坎医学院的科学家们开展合作研究,在体细胞重编程的分子机制研究方面取得突破,发现转录因子Nac1参与调控体细胞重编程。这项研究发表在《干细胞报道》(Stem Cell Reports)上。 多能性干细胞能够转化为体内的任何一种类型的细胞,典型的多能性干细胞包括胚胎干细胞(ESCs)和诱导多能干细胞(iPSCs)。胚胎干细胞分离自哺乳动物胚胎早期的内细胞团,诱导多能干细胞是通过细胞核重编程,将已终末分化的、仅具有单一潜能的体细胞转变为可多向分化的、具有多能分化特性的细胞。诱导多能干细胞与胚胎干细胞具有类似的特性,可分化为三胚层,亦可产生原始生殖细胞(PGCs)。因此,诱导多能干细胞具有替代胚胎干细胞的能力,不仅可避免医学上使用胚胎干细胞存在的伦理问题,还可为细胞治疗、自体医疗、药物筛选以及毒理学研究提供有利帮助。 Nac1表达的蛋白最初发现于大鼠脑的伏核中,多种癌症细胞中也存在高表达。在胚胎干细胞中,Nac1与多种干细胞因子具有相互作用,特别是和多能性相关的Nanog,以及和已被诺贝尔奖得主Yamanaka证实的重编程因子Oct4、Sox2均具有相互作用,但这些因子间的相互作用过程及机制尚未阐明。 生态中心研究员Faiola与美国科学家合作,证实转录因子Nac1通过调节粘附因子E-cadherin的表达,进而影响体细胞重编程过程。Nac1下调E-cadherin的阻抑基因Zeb1,直接作用于基因位点抑制转录,并间接通过影响miR200家族从而调控Zeb1的mRNA水平。
Nac1调节Zeb1和E-cadherin介导的重编程。(A):Nac1表达情况下体细胞重编程示意图;(B):Nac1缺失情况下体细胞重编程示意图。 |
| © 1996 - 中国科学院 版权所有 备案序号:京ICP备05002857号 联系我们 地址:北京市三里河路52号 邮编:100864 |