|
|
|||||||
| 上海有机所等揭示真菌非核糖体肽大环环合的结构机制 |
| 文章来源: | 上海有机化学研究所 | 发布时间: | 2016-10-27 |
|
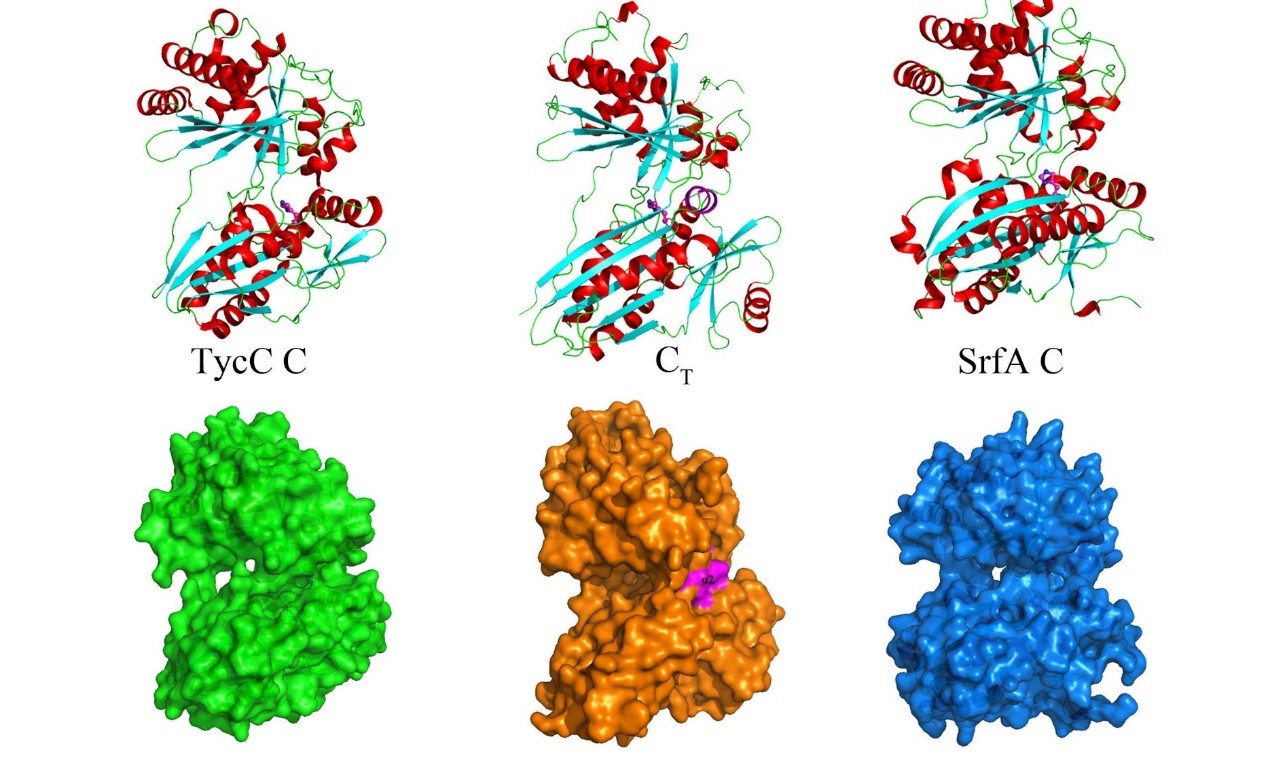
由细菌或真菌通过自身代谢合成的天然多肽化合物,例如青霉素、环孢素、棘白霉素类化合物等,许多都具有抗菌或抗肿瘤活性,是国内外新药创制的重要源泉。它们的生物合成途径分为两类,一类通过核糖体来源的多肽进行缩合、修饰及环合,另一类则通过一种具有高度模块化特征的非核糖体多肽合酶(NRPS)将天然或非天然的氨基酸逐一组装起来,这种工作机制兼具高效性和灵活的特异性,保证了天然多肽产物结构的多样性。对细菌和真菌非核糖体多肽合酶的组装、结构和催化机制研究,有助于深入了解天然多肽化合物的生物合成机制,并使通过组合生物合成手段获得更多有生物活性的多肽化合物成为可能。 早期的研究表明:细菌来源的NRPS途径链状多肽产物的释放与环合是通过硫酯酶(thioesterase, TE)完成的,而真菌NRPS则经常由一个类似于缩合结合域的功能域(CT功能域)来控制多肽产物生物合成的终止与环合。为了从分子机制上阐明CT功能域如何在控制真菌NRPS生物合成终止过程中发挥作用,中国科学院上海有机化学研究所生命有机化学国家重点实验室的周佳海研究团队分别解析了CT功能域(1.8埃分辨率)和处于活化状态的T-CT复合物(2.49埃分辨率)的晶体结构,发现经典缩合结构域的一段N端环状区域被CT功能域相应的α1螺旋所取代,并导致α2螺旋向活性口袋邻近的接纳位点靠近(见下图),从而阻滞了与T功能域相连的底物上载到接纳位点上进行新一轮的肽基延伸反应。 T-CT复合物晶体结构揭示一旦T功能域被活化后,磷酸泛酰巯基将参与稳定T与CT的相互作用,并从CT功能域活性口袋的一侧接纳线状多肽产物,完成最终环状多肽产物的合成与释放。这不仅解释了真菌NRPS中CT功能域为何必须依赖T功能域才发挥作用,也为通过合理设计来产生不同大小与结构的新型大环多肽天然产物提供了技术蓝图。 该课题是与美国加州大学洛杉矶分校教授Yi Tang和中科院武汉数学物理研究所研究员唐淳合作完成的,得到了国家自然科学基金委面上项目和上海市科委项目的资助,晶体衍射数据分别在国家蛋白质科学(上海)研究中心的BL19U1、上海光源的BL17U1及日本光工厂的BL5a线站收集。主要成果已于10月18日在国际期刊《自然-化学生物学》(Nature Chemical Biology)上在线发表,上海有机所博士张金儒是论文的第一作者。
真菌非核糖体肽大环环合的结构机制 |
| © 1996 - 中国科学院 版权所有 备案序号:京ICP备05002857号 联系我们 地址:北京市三里河路52号 邮编:100864 |