α-突触核蛋白(α-syn)作为帕金森病(PD)、路易体痴呆(DLB)、多系统萎缩(MSA)等神经退行性疾病的关键致病蛋白,具有在不同条件下形成不同结构和病理毒性的淀粉样纤维聚集的能力。近期研究发现,来自MSA,PD及DLB患者脑中的α-syn病理纤维结构均含有不同的化学配体通过与附近氨基酸残基的非共价作用参与特定α-syn聚集纤维构象的形成。尽管这些化学配体尚未获得鉴定,但显然与α-syn纤维的构象选择以及病理毒性高度相关。因此,不同的化学配体如何影响α-syn病理聚集并决定纤维结构是本领域的重要的前沿科学问题。
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组与上海交通大学Bio-X研究院李丹课题组合作,在《自然-通讯》(Nature Communications)上,发表了题为Heparin induces α-synuclein to form new fibril polymorphs with attenuated neuropathology的研究成果,报道了富含负电的糖胺聚糖——肝素(heparin)能够高效的诱导α-syn形成全新构象的聚集纤维复合物(hep-α-syn)。hep-α-syn纤维复合物通过削弱α-syn纤维被细胞摄取的效率以及播种能力,减弱其在神经元上的病理毒性。进一步的机制研究发现,heparin作为长链生物多聚物能够通过在分子内和原纤维间水平上重排α-syn的电荷互作模式来调控α-syn纤维的折叠和组装,从而诱导产生具有全新结构的α-syn纤维构象。该研究揭示了化学配体在调控病理淀粉样纤维的构象选择和病理毒性中的重要作用。
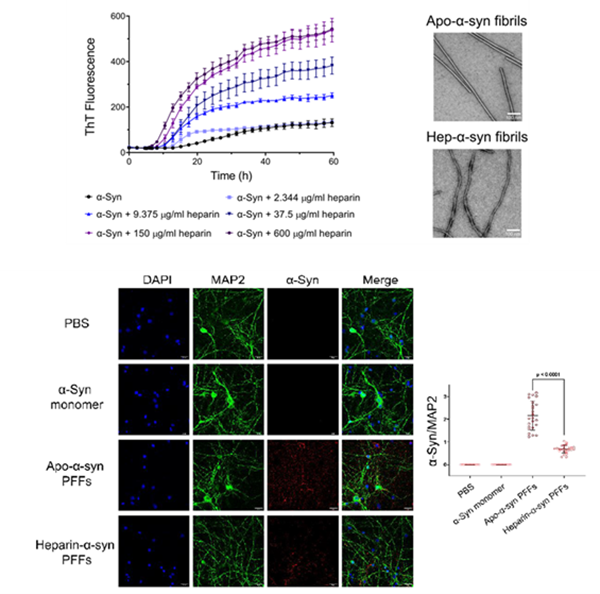
研究发现,相比于apo-α-syn对照组,糖胺聚糖heparin显著加速α-syn单体的聚集纤维化速率并诱导其形成具有不同形态的hep-α-syn纤维(图1)。更为重要的是,具有新颖形态的hep-α-syn纤维与apo-α-syn纤维对比,在神经元水平呈现出显著降低的病理毒性(图1)。研究通过更细致的表征hep-α-syn纤维复合物的“病理功能画像”(pathological profile)发现,heparin诱导产生纤维神经病理毒性的降低是通过三方面来实现,即削弱纤维与神经元细胞表面结合、降低纤维被神经元细胞摄取的效率、抑制纤维在神经元中播种和诱导内源α-syn聚集的能力。
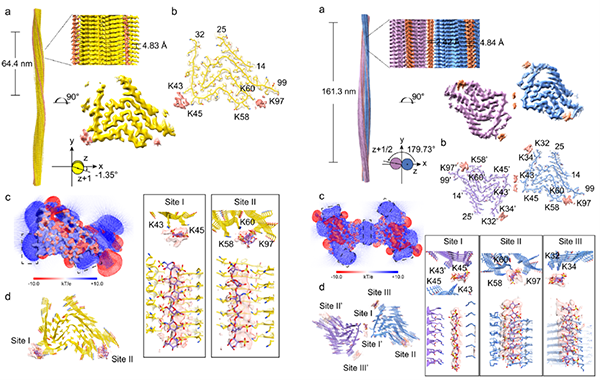
进一步,研究运用冷冻电镜(cryo-EM)三维螺旋重构技术,解析了hep-α-syn纤维的高分辨率电镜结构,发现了其由4种不同的纤维构象(polymorphs)构成(分别命名为Hep-P1、Hep-P2、Hep-P3、Hep-P4)。在hep-α-syn的polymorphs结构中可以明确观察到存在于α-syn纤维周围或原纤维界面的额外密度,这些密度靠近α-syn表面的赖氨酸(Lys)残基(图2)。研究通过分子对接搭建heparin和α-syn纤维相互作用的原子模型,发现作为富含负电的生物聚合物,heparin能够通过其磺酸基团沿纤维轴结合在由Lys形成的正电表面上(图2)。
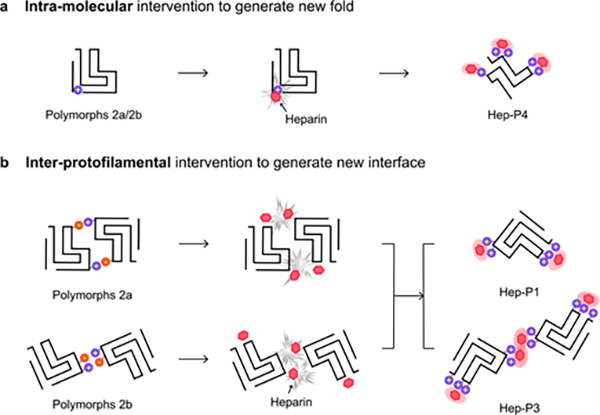
进一步分析发现,Hep-P1、Hep-P2及Hep-P3的原纤维核心结构与体外重构的α-syn polymorph 2相似,而heparin与Lys的电荷相互作用稳定了这些polymorphs的原纤维组装界面,从而介导新的polymorphs形成。在Hep-P1中,heparin稳定了α-syn的单股原纤维表面;而在Hep-P3中,heparin介导两股原纤维形成新的组装界面(图3)。此外,heparin通过诱导分子内的结构重排,使Hep-P4折叠成全新的“Z”形构象。Heparin与Lys80的静电相互作用使其暴露于溶剂中,并阻止了N端的包裹。Hep-P4纤维核心的N端具有与α-syn Polymorph 2相似的拓扑结构,其C端具有与α-syn Polymorph 1相似的拓扑结构,使其表现为α-syn纤维结构中两种常见“构象原型”(prototype)的混合体纤维构象。
该研究通过对hep-α-syn纤维复合物的动态组装机制、细胞毒性以及纤维原子结构的系统研究,阐释了糖胺聚糖作为一种特定形式的化学配体是如何通过复杂的非共价相互作用调控病理淀粉样纤维的折叠和组装并影响其病理毒性。该工作为剖析其他生物大分子诱导病理淀粉样纤维聚集体在神经退行性疾病中的演化和病理作用奠定了基础,并为设计与发展化学配体抑制神经退行性疾病关键蛋白聚集体的病理毒性提供了新思路。
浙江大学生命科学学院、四川省人民医院神经病学研究所的科研人员参与研究。
图1.Heparin诱导促进α-syn形成全新纤维构象,并呈现显著降低的神经元毒性
图2.Heparin诱导α-syn形成具有构象多态性的纤维原子结构分析
图3.Heparin诱导α-syn形成不同polymorphs的机制示意图



 京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002