主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

6月25日,中国科学院生物物理研究所研究员叶克穷课题组和北京生命科学研究所研究员杜立林课题组合作,在《自然-通讯》(Nature Communications)上,发表了题为Structural mechanism of protein recognition by the FW domain of autophagy receptor Nbr1的论文。该研究发现了自噬受体Nbr1的FW结构域如何识别蛋白质的结构机制。
自噬将细胞质的物质运送到溶酶体进行降解,该过程对维持细胞稳态至关重要。Nbr1是保守的自噬受体,在选择性自噬中特异性识别货物。Nbr1在不同真核生物中含有不同组合的结构域,却都有一个标志性而功能尚不清楚的FW结构域。
该研究首先发现来自丝状真菌Chaetomium thermophilum的Nbr1通过FW结构域结合α-甘露糖苷酶Ams1,并在异源的裂殖酵母中能利用传统的自噬系统把Ams1运输到液泡。研究利用冷冻电镜技术解析了Ams1和Nbr1 FW结构域复合物的高分辨率结构,发现FW结构域同时结合Ams1四聚体中两个亚基,从而识别其四级结构。该结构显示FW结构域的一个高度保守的口袋能特异的识别Ams1 N端肽链的两个甘氨酸。裂殖酵母Nbr1的FW结构域在肽链结合口袋区域发生突变,而利用另一个ZZ结构域识别Ams1。这一研究首次揭示了FW结构域识别蛋白质的方式,并显示了Nbr1结合货物蛋白质方式的多样性。
研究工作得到国家自然科学基金、中科院战略性先导科技专项、国家重点研发计划和北京市等的支持。
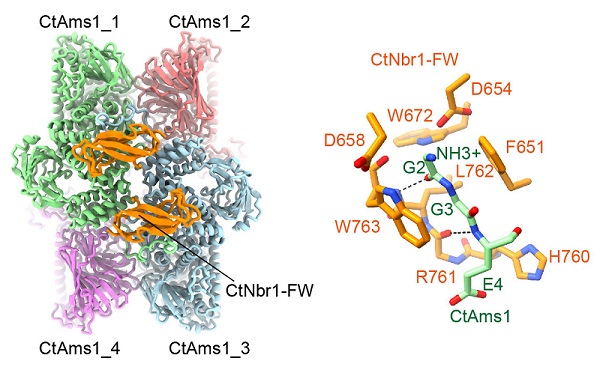
Ams1和Nbr1 FW复合物的冷冻电镜结构

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














