
语音播报

2020年,基于CRISPR-Cas9系统建立的基因组编辑技术获得“2020年度诺贝尔化学奖”。该生物技术起源于科学家对微生物中一种特殊的免疫系统(即CRISPR-Cas系统)的研究。CRISPR-Cas系统是在原核微生物(古菌和细菌)中广泛存在的抗病毒(噬菌体)免疫系统。宿主菌通过将入侵病毒的特定DNA序列插入其CRISPR结构中,可形成对该病毒的永久性“记忆”。这些记忆性序列(称为spacer)可转录加工生成crRNA,指导CRISPR-Cas系统效应物(如Cas9或Cascade复合物)特异性识别和切割再次入侵的病毒,实现对该类病毒的适应性免疫。CRISPR-Cas系统丰富多样的功能组分和核酸靶向机制,为人类提供了迄今最高效的基因组编辑技术(如CRISPR-Cas9系统)和基因检测技术(如CRISPR-Cas13a系统),是近十余年来生命科学研究的前沿。
CRISPR-Cas系统在微生物基因组中稳定性维持是其抗病毒功能实现的关键基础。一方面,CRISPR-Cas系统具有自我免疫的风险,并可能阻碍有益外源基因的获取,因此可对宿主细胞造成适合度代价(fitness cost)而可能在进化过程中频繁丢失。另一方面,微生物宿主与其病毒的“军备竞赛”中,CRISPR-Cas系统也会成为病毒反攻(Anti-CRISPR)的目标而丧失功能。面对多重的进化压力和适应性挑战,CRISPR-Cas系统为何能在微生物中广泛存在(存在于约90%的古菌和40%细菌中)并发挥其功能?在微生物宿主基因组中是否存在一类保护CRISPR-Cas功能但至今尚未被揭示的“暗物质”?这些问题有待进一步探究。
2021年4月30日,Science以长文形式在线发表了中国科学院微生物研究所研究员向华/李明团队的最新研究成果,论文题目为Toxin-antitoxin RNA pairs safeguard CRISPR-Cas systems。科研人员首次在自然界分布广泛的I型CRISPR-Cas基因簇内部发现了一类特殊的RNA“暗物质”:一类对其偶联的CRISPR-Cas系统具护卫功能的一对RNA的毒素-抗毒素(CreTA)系统。由于CRISPR-Cas系统可利用RNA抗毒素CreA控制RNA毒素CreT的表达,使宿主菌无法丢失其CRISPR-Cas系统(对其“上瘾”)。一旦CRISPR-Cas组分被破坏,就会诱导CreT毒素的表达,从而抑制甚或杀死该宿主菌(图1),从而保护CRISPR-Cas系统在细胞群体中的稳定存在。“成瘾”机制的发现为理解CRISPR-Cas系统的稳定性维持和广泛性分布提供了全新视角,研究还揭示了一大类新的功能多样的小RNA(曾被称为基因组中的“暗物质”),开辟了新的研究领域。
2014年,向华/李明团队即利用西班牙盐盒菌(Haloarcula hispanica)及其病毒在国际上建立了第一个I型CRISPR系统的高效适应模型,揭示出CRISPR系统对病毒高效适应需要引发的规律,并深入解析了“引发适应”过程精细的分子机制,包括Cascade与crRNA的可塑性。研究发现,4个成簇的编码CRISPR效应复合物Cascade的基因(cas6-cas8-cas7-cas5)无法单独敲除,但可作为整体一起敲除,从而推测这个基因簇内部可能隐藏了一个未知的“细胞成瘾”元件。经过7年探索,科研人员最终在cas6与cas8之间一段仅311 bp的基因间区内发现一类新的小RNA毒素-抗毒素系统,分别命名为CreT(RNA毒素)和CreA(RNA抗毒素)。CreTA通过与CRISPR效应复合物4个编码基因的结构与功能的偶联,守护了CRISPR-Cas系统的稳定性(图1)。该研究的主要创新性发现包括:首次发现受Cascade蛋白控制的小RNA毒素;解析了小分子RNA毒素CreT独特的抑菌机制;发现CreA抗毒素——类似crRNA的小分子RNA;揭示CreA RNA联合Cascade发挥抗毒素活性的分子机制;揭示CreTA对CRISPR-Cas系统的护卫功能;揭示CreTA同源或类似系统在不同微生物和不同CRISPR亚型中的普遍存在。
微生物所研究员向华和李明为该论文共同通讯作者,李明、向华研究组博士后龚路遥和博士生程飞跃为论文并列第一作者。美国国立卫生研究院(NIH)生物技术信息中心(NCBI)教授Eugene Koonin及其团队给予了帮助。研究工作得到中科院战略性先导科技专项、国家重点研发计划、国家自然科学基金、国家转基因重大科技专项、中国科协青年人才托举工程和中科院青年创新促进会等的支持。
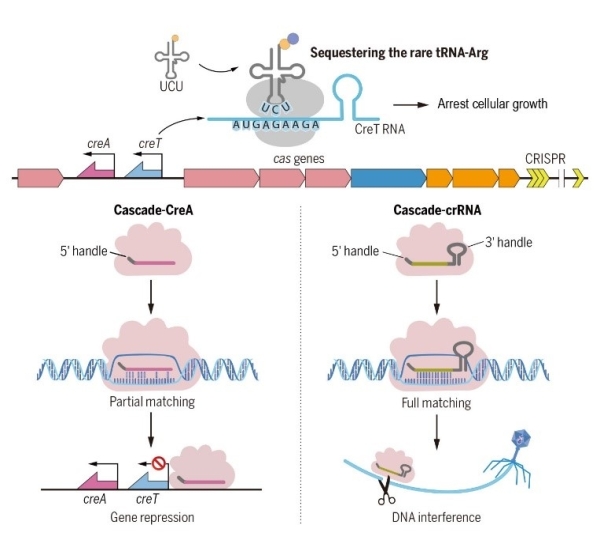
图1.CRISPR-Cas系统与CreTA毒素-抗毒素系统的互作机制
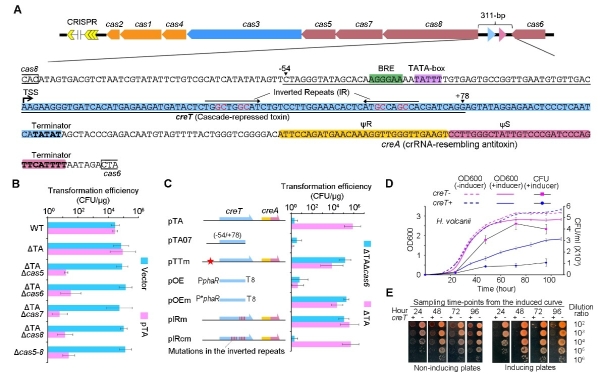
图2.creTA在CRISPR-cas基因簇中的位置及功能分析

图3.CreT毒素通过劫持胞内稀有的精氨酸tRNAUCU抑制菌体生长
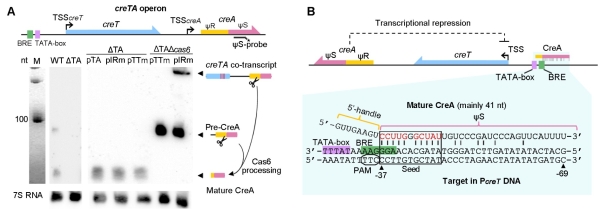
图4.CreA模拟crRNA指导Cascade特异性抑制creT启动子
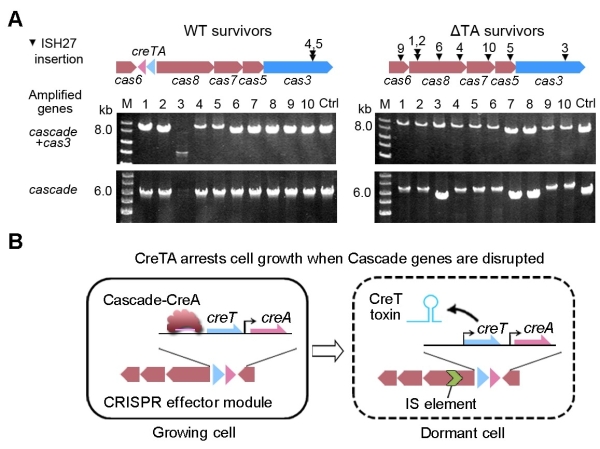
图5.CreTA保护Cascade基因簇的遗传稳定性

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
