主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

病毒在与宿主长期的博弈过程中,进化出多种机制来对抗和逃避宿主的抗病毒反应。其中,通过干预宿主的mRNA出核转运过程,进而阻止宿主细胞建立合适的抗病毒环境,是重要策略之一。例如,甲型流感病毒NS1蛋白和水疱性口炎病毒的M蛋白均被发现可以广谱抑制宿主mRNA出核转运。2016年,一项研究发现,γ疱疹病毒(如卡波西肉瘤相关病毒KSHV和鼠γ疱疹病毒MHV68)编码的ORF10蛋白,可以通过与宿主mRNA转运复合物Rae1-Nup98相互作用,特异性抑制部分宿主mRNA的出核转运。ORF10是疱疹病毒中第一个被发现可以抑制宿主mRNA出核转运的毒力蛋白,也是目前报道的第一个能选择性抑制特定mRNA转运的病毒蛋白。然而,ORF10与Rae1-Nup98复合物互作的结构基础,以及ORF10发挥抑制功能的分子机制,目前仍不清楚。
10月8日,中国科学院生物物理研究所高璞课题组与邓红雨课题组合作,在PNAS上发表题为Molecular mechanism underlying selective inhibition of mRNA nuclear export by herpesvirus protein ORF10的研究论文,该研究综合运用生物化学、结构生物学及细胞生物学手段,解析γ疱疹病毒ORF10与宿主mRNA转运复合物Rae1-Nup98的互作细节,确认ORF10的RNA结合能力及其重要功能,并揭示ORF10选择性抑制mRNA出核转运的作用机理。
研究人员利用昆虫细胞表达系统,制备出状态良好的ORF10-Rae1-Nup98三元复合物样品,并解析该复合物2.5Å分辨率的晶体结构。结构分析发现,ORF10与Rae1-Nup98复合物存在两个主要的互作界面。在这两个互作界面中,ORF10两个高度保守的氨基酸L60和M413贡献重要的疏水相互作用。通过Co-IP、体外Pull-down、GFP报告基因的表达测定、GFP-mRNA的核质分布测定、RNA FISH成像等多种生化细胞实验,研究明确L60和M413对维持ORF10与Rae1-Nup98的相互作用、以及对维持ORF10的mRNA出核转运抑制功能均十分重要。
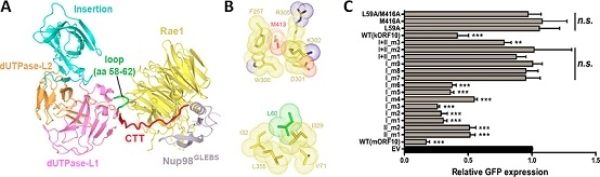
ORF10-Rae1-Nup98复合物结构、互作细节、及突变体对GFP报告基因表达的影响
虽然ORF10占据Rae1-Nup98复合物自身的RNA结合口袋,但是ORF10-Rae1-Nup98三元复合物保持足够强的RNA结合能力。研究推测ORF10本身可能具备与RNA的直接结合能力。后续生化实验证实ORF10可直接结合RNA。通过对ORF10表面的正电荷聚集区进行系统突变,确定其结合RNA的位点,并发现ORF10与RNA的互作对其发挥抑制mRNA出核转运的功能至关重要。
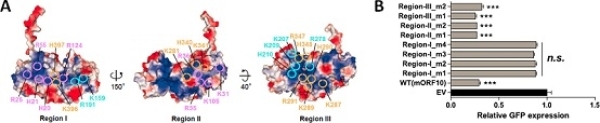
ORF10表面电荷分布,以及突变体对GFP报告基因表达的影响
综上,该研究解析γ疱疹病毒ORF10蛋白与宿主mRNA出核转运复合物Rae1-Nup98的三元复合物结构,明确两个重要的病毒-宿主互作界面及关键氨基酸,发现ORF10直接结合RNA的能力及其对抑制宿主功能的重要性。此外,研究还发现,完全不同的病毒蛋白(如γ疱疹病毒的ORF10蛋白和水疱性口炎病毒的M蛋白)均可以结合到Rae1-Nup98的RNA结合口袋,这提示该位点的重要性,也为设计新的抗病毒疗法提供思路。
生物物理所研究员高璞和邓红雨为论文的共同通讯作者。高璞组副研究员冯菡和邓红雨组助理研究员田华彬为论文的共同第一作者。生物物理所研究员俞洋参与RNA实验的指导工作。国家蛋白质科学研究(上海)设施BL17B1线站、BL18U1线站及BL19U1线站工作人员,为X射线晶体学衍射数据收集提供有效支持。研究工作得到科技部、国家自然科学基金委员会和中科院的资助。
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














