主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

三阴性乳腺癌 (TNBC) 缺少雌激素受体 (ER) 、孕激素受体 (PR) 和人表皮生长因子受体2(HER2)的表达,是恶性程度高、易转移、高复发和预后差的一类乳腺癌。由于缺乏有效的治疗靶点,化疗是TNBC主要的治疗方式之一,然而化疗药物能够杀死正在分裂的肿瘤细胞,却不能有效作用于肿瘤干细胞,从而导致肿瘤干细胞的富集,进而产生TNBC的耐药性。因此由肿瘤干细胞介导的耐药性是TNBC治疗的研究难点之一。
中国科学院昆明动物研究所焦保卫团队与陈策实团队合作,结合TNBC单细胞测序数据,鉴定了一个在乳腺癌干细胞(BCSC)中高表达的基因-SGCE。表型分析发现SGCE对于乳腺癌干细胞的自我更新不可或缺。在机制探讨上,发现SGCE与E3泛素连接酶c-Cbl相互结合,SGCE缺失促进c-Cbl释放出来而泛素化其底物蛋白EGFR,从而使得EGFR进入网格蛋白介导和巨胞饮途径的内化,内化的EGFR进而进入溶酶体降解。EGFR的降解导致其下游通路被阻断并最终抑制BCSC自我更新和胞外基质ECM的累积。SGCE在BCSC中高表达时,SGCE与c-Cbl相互结合,EGFR能够正常激活其下游信号通路PI3K-AKT,促进BCSC干性维持、肿瘤细胞迁移、化疗药物和靶向EGFR抑制剂的耐药性。
EGFR在超过50% TNBC病人中高表达,与乳腺癌细胞增殖、转移和BCSC的干性维持密切相关,然而EGFR的抑制剂(如吉非替尼和拉帕替尼)在乳腺癌中的临床治疗效果并不显著。SGCE分子帮助维持BCSC中EGFR高表达,去除SGCE的表达则可以促进TNBC中的EGFR靶向治疗效果,从而为EGFR与其它靶点的联合治疗提供新策略。
该项研究成果近期发表在Advanced Science期刊上。昆明动物所的赵丽娜、邱婷和蒋德伟为该文的共同第一作者。焦保卫和陈策实为该文的共同通讯作者。
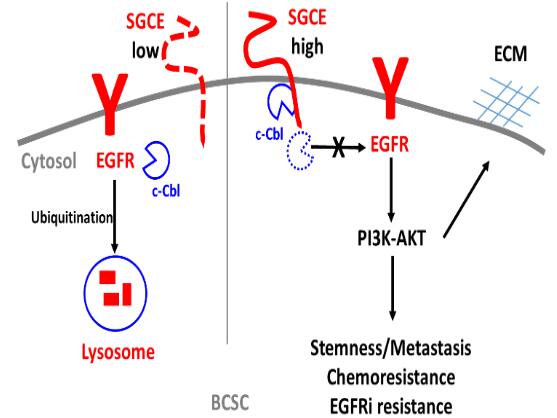
SGCE通过调控EGFR而贡献于乳腺癌干细胞的自我更新
扫一扫在手机打开当前页

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














