院况简介
1949年,伴随着新中国的诞生,中国科学院成立。
作为国家在科学技术方面的最高学术机构和全国自然科学与高新技术的综合研究与发展中心,建院以来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全做出了不可替代的重要贡献。 更多简介 +
院领导集体
创新单元
科技奖励
科技期刊
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

3月30日,国际学术期刊《核酸研究》(Nucleic Acids Research)在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王恩多研究组与上海科技大学刘如娟研究组的最新研究成果“Molecular basis of the multifaceted functions of human leucyl-tRNA synthetase in protein synthesis and beyond”。
人胞质亮氨酰-tRNA合成酶(hcLRS)是由十个结构域组成的复杂的多功能氨基酰-tRNA合成酶(aaRS)。除了经典的催化tRNA氨基酰化的功能,为蛋白质合成提供原料外,hcLRS还可以作为亮氨酸感受器,通过与RagD直接相互作用调控雷帕霉素复合物1(mTORC1)信号通路。同时,它还参与了细胞质多氨酰基-tRNA合成酶复合物(MSC)的组装。然而,目前hcLRS多功能的分子基础和参与MSC组装的机制都不清楚,特别是hcLRS如何在感受亮氨酸后从氨基酰化功能转换到结合RagD去调控亮氨酸感受器。
博士龙韬、博士研究生李浩及其同事在分子细胞卓越中心王恩多和上海科技大学刘如娟(原王恩多研究组研究员)的指导下合作解析了hcLRS 2.5的晶体结构,是目前解析的第一个完整的真核LRS结构。结合生物化学实验和酶学动力学研究,他们揭示了hcLRS的氨基酰化和编校活性中心关键氨基酸残基的作用;发现tRNA和RagD都结合到hcLRS的VC(vertebrate C-terminal)结构域,它们与hcLRS的结合是互相排斥的,为hcLRS发挥tRNA氨基酰化的经典功能和非经典功能的转换提供结构基础;阐明了hcLRS通过与异亮氨酰-tRNA合成酶(IRS)的直接相互作用参入到MSC中;基于hcLRS的结构,他们还分析了靶向hcLRS不同结构域的多种小分子化合物的结合方式并提供了优化这些化合物的方案。他们的研究结果为hcLRS的生物学功能和靶向LRS药物的合理设计提供了新的认识。
该工作得到国家重点研发计划、基金委、中科院和上海市科委的经费资助。该工作还得到欧洲分子生物学中心(EMBL,Grenoble,France)、复旦大学和安徽大学等单位合作者的帮助。
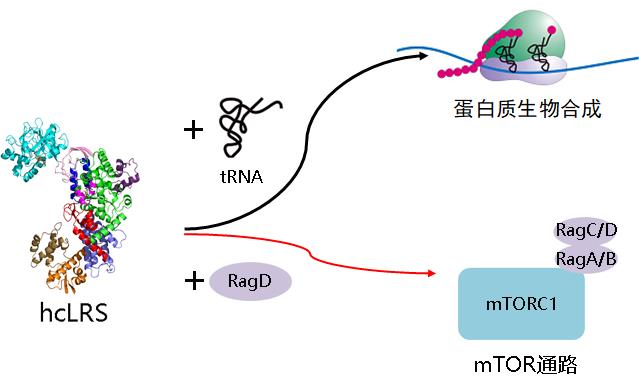
hcLRS的经典功能和非经典功能

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
编辑部邮箱:casweb@cashq.ac.cn
© 1996 - 中国科学院 版权所有 京ICP备05002857号-1 京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)
编辑部邮箱:casweb@cashq.ac.cn
© 1996 - 中国科学院 版权所有
京ICP备05002857号-1
京公网安备110402500047号
网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话:86 10 68597114(总机)
86 10 68597289(总值班室)
编辑部邮箱:casweb@cashq.ac.cn











