主要职责
中国科学院贯彻落实党中央关于科技创新的方针政策和决策部署,在履行职责过程中坚持党中央对科技工作的集中统一领导。主要职责是:
一、开展使命导向的自然科学领域基础研究,承担国家重大基础研究、应用基础研究、前沿交叉共性技术研究和引领性颠覆性技术研究任务,打造原始创新策源地。 更多+
院况简介
中国科学院是国家科学技术界最高学术机构、国家科学技术思想库,自然科学基础研究与高技术综合研究的国家战略科技力量。
1949年,伴随着新中国的诞生,中国科学院成立。建院70余年来,中国科学院时刻牢记使命,与科学共进,与祖国同行,以国家富强、人民幸福为己任,人才辈出,硕果累累,为我国科技进步、经济社会发展和国家安全作出了不可替代的重要贡献。 更多+
院领导集体
科技奖励
科技期刊
科技专项
科研进展/ 更多
工作动态/ 更多
工作动态/ 更多
中国科学院学部
中国科学院院部

语音播报

11月28日,国际学术期刊《科学进展》(Science Advances)在线发表了中国科学院广州生物医药与健康研究院刘兴国课题组的最新研究成果“Phospholipid remodeling is critical for stem cellpluripotency by facilitating mesenchymal-to-epithelial transition”。该研究发现磷脂在体细胞重编程为诱导多能干细胞(iPSC)过程中发挥动态重塑功能,并鉴定出其中的磷脂酰乙醇胺为多能性获得和维持中的关键脂类分子,其通过信号转导调控“间充质-上皮转换(MET)”这一重编程早期关键事件。这一工作揭示了磷脂并非通过膜转运,而是通过信号调控细胞命运的全新工作模式,为研究脂类代谢在多能干细胞干性获得、维持及失去中的功能提供新的视角和理论依据。
磷脂是大多数哺乳动物细胞内含量最高的脂类,其不仅作为细胞质膜和细胞器膜的主要结构组分,还参与调控许多生理病理过程。磷脂对小鼠胚胎正常生长发育至关重要,敲除小鼠多个磷脂生成的相关基因,如Chkα、Pcyt1、Pcyt2等,会导致其胚胎致死。然而磷脂是否及如何调控多能性的维持、失去及获得仍不清楚,具体哪些磷脂发挥作用仍需回答。
刘兴国组利用高精准高覆盖的脂质组学检测了体细胞重编程不同时间点的磷脂组成,发现了多种磷脂在重编程过程中的动态变化规律。其中,磷脂酰乙醇胺在重编程早期骤然升高随后下降,提示其可能在重编程早期发挥关键作用。这一升高是通过CDP-乙醇胺途径实现,有利于体细胞重编程为诱导多能干细胞。通过进一步的机制研究,课题组发现磷脂酰乙醇胺在重编程中并没有影响自噬等膜转运事件,而是通过促进其结合蛋白Pebp1与IKKα/β的相互作用,抑制IKKα/β的磷酸化及NF-κB的入核,从而抑制了间充质相关基因的表达,来促进“间充质-上皮转换”。而在多能性维持方面,磷脂酰乙醇胺同时具有调控胚胎干细胞生长的功能。
细胞质膜与细胞器膜如同细胞的围墙一样,把细胞内隔成若干相对独立的空间。磷脂作为膜组分,一般被认为通过动力学影响细胞命运。然而,正如长城这样的围墙,除了基本功能外,还可以承担“烽燧”这样的信号传递功能,该研究发现细胞器膜组分发挥“千里望狼烟”的信号作用,直接到达细胞核“运筹中军帐”,通过基因表达实现细胞形态的转变。
重要的是,这一细胞代谢调控细胞形态转变的全新“烽燧”模式,将磷脂、细胞迁移及细胞命运联系起来。因为“间充质-上皮转换”不但在发育分化中必需,而且在肿瘤转移中发挥重要作用,这一工作为探索细胞命运的生理调控和癌症的病理调控提供了全新的思路。
该研究获得国家重点研发项目、中科院、国家自然科学基金、广东省和广州市的经费支持。
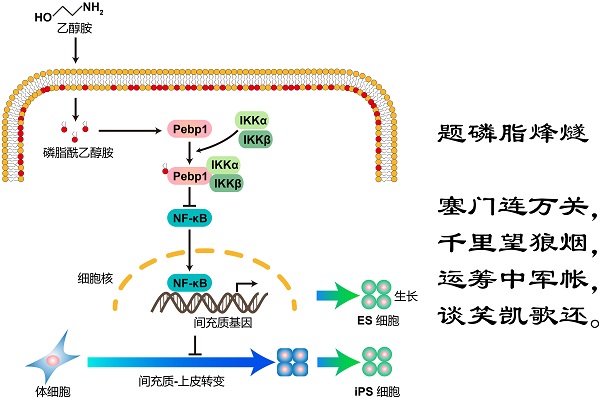
广州健康院发现磷脂调控多能干细胞命运的全新“烽燧”模式

© 1996 - 中国科学院 版权所有 京ICP备05002857号-1  京公网安备110402500047号 网站标识码bm48000002
京公网安备110402500047号 网站标识码bm48000002
地址:北京市西城区三里河路52号 邮编:100864
电话: 86 10 68597114(总机) 86 10 68597289(总值班室)














