Sirt6蛋白酶结构和新功能的研究获得重要进展
4月4日,香港大学郝权教授研究组与康奈尔大学Hening Lin教授研究组在《自然》杂志发表了题为Sirt6 regulates TNFα secretion via hydrolysis of long chain fatty acyl lysine的论文,报道了在Sirt6蛋白酶结构和新功能的研究的最新进展。
Sirtuin就是一种通过专一去除靶标蛋白的赖氨酸上已有的修饰(乙酰化修饰)来广泛调节一系列细胞生理活动的重要蛋白酶家族。由于它不仅涉及到细胞的衰老凋亡调控,更对肿瘤细胞的增殖等都有着决定性的意义,所以了解Sirtuin家族蛋白酶的真正的结构和功能,对我们通过基于三位结构的药物设计方法研发重要的激活或是抑制性的药物有着重要的意义。
但是,不是所有的 Sirtuin家族成员(Sirt1-7)都具有经典的去乙酰化修饰的功能。由香港大学郝权教授研究组与康奈尔大学Hening Lin教授研究组在继发现人源Sirt5的去琥珀酰修饰的功能后,再一次对人源Sirt6的功能进行了研究。通过尝试各种不同的酰基基团后,研究人员确认Sirt6对豆蔻酰基和棕榈酰基具有更高的活力。利用上海光源生物大分子晶体学光束线站(BL17U1)的高分辨率的X射线衍射,郝权教授研究组解析了人源Sirt6、豆蔻酰基化的多肽和ADP核糖的高分辨率的复合物结构,揭示了人源 Sirt6在调节TNF-alpha的分泌过程中具有去除其赖氨酸上的豆蔻酰化的功能。这对基于结构的小分子药物设计来治疗因Sirt6功能的缺失或是加强带来的细胞衰老现象,抑或是肿瘤的发生提供了关键的结构基础。《自然》杂志同期刊发评论指出,Sirt6介导的去豆蔻酰基功能开启了研究人类Sirtuin家族成员生物活性的新篇章。

图为人源Sirt6与其底物豆蔻酰化赖氨酸多肽的复合物结构
能量耦合因子转运蛋白结构与转运机制研究获得重要进展
4月14日,《自然》杂志同时在线发表了清华大学施一公课题组和中国科学院上海生命科学院张鹏课题组关于能量耦合因子转运蛋白(energy-coupling factor transporter)结构与转运机制研究的两篇论文。施一公课题组和张鹏课题组分别独立研究和报道了来源于乳酸杆菌的两种不同配体的能量耦合因子转运蛋白——羟甲基嘧啶转运蛋白和叶酸转运蛋白的结构与转运机制。
能量耦合转运蛋白是一类近年来新鉴定的转运蛋白,广泛存在于革兰氏阳性病原菌之中,负责摄入一些维生素及其他微量元素。该转运蛋白复合物包含4个组分:两个结合并水解ATP提供能量的亲水蛋白(EcfA和EcfA′),一个识别和转运底物的膜蛋白(EcfS)和另一个传递能量的膜蛋白(EcfT)。
施一公课题组和张鹏课题组经过不懈努力,分别利用上海光源生物大分子晶体学线站(BL17U1)解析出了这两种不同配体的能量耦合因子转运蛋白。通过分析该蛋白结构,研究人员发现膜蛋白EcfS与细胞膜基本处于平行状态,而一般膜蛋白基本是垂直于细胞膜。根据这个极其特殊的构象,研究人员认为转运蛋白EcfS通过在膜内翻转来摄入底物。当处于垂直细胞膜的状态时,EcfS可以与底物结合,然后翻转进入平行状态并释放底物,之后返回垂直状态进行下一轮循环,类似于酒杯在竖直状态下接水,然后翻转倒出杯内的水。在该过程中,亲水蛋白EcfA和EcfA′水解ATP并耦合膜蛋白EcfT为EcfS的翻转提供能量。这一转运模式有别于目前对于转运蛋白通用的“alternating access”模型,是一种崭新的膜转运蛋白工作模型。
此次解析的叶酸ECF转运蛋白结构是叶酸跨膜转运蛋白的首个结构。这一研究成果是膜转运蛋白研究领域的重大突破,一方面使人们对ABC转运蛋白跨膜转运的机理有了全新的理解,更为重要的是为人们理解维生素(特别是叶酸)如何跨细胞膜转运进入细胞的过程迈出了一大步。此外,由于该转运蛋白只存在于细菌里,可以针对这类蛋白筛选或设计新的抗菌药。因此本次研究成果不仅是阐述能量耦合因子转运蛋白工作机制方面的一次突破,也对于解决日益严重的细菌抗药性等问题有着参考价值。

图为羟甲基嘧啶转运蛋白转运蛋白结构
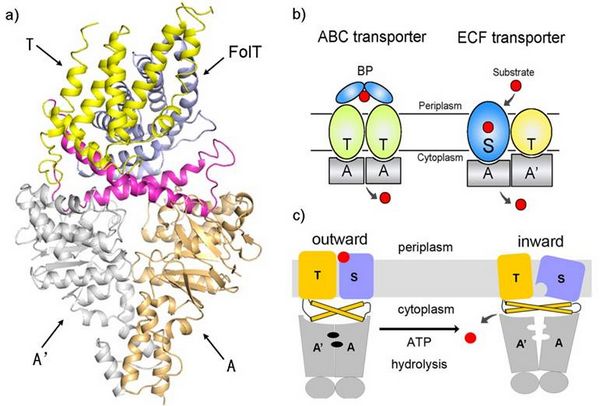
图为叶酸转运蛋白结构及其可能的转运机制 |

 联系我们
联系我们